
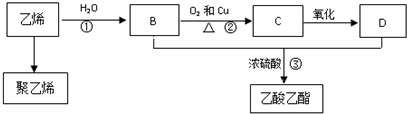
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O. 分析 乙烯和水发生加成反应生成B,B为CH3CH2OH,B被催化氧化生成C,C为CH3CHO,C被氧化生成D,D为CH3COOH,B、D发生酯化反应生成乙酸乙酯,乙烯发生加聚反应生成聚乙烯,以此解答该题.
解答 解:乙烯和水发生加成反应生成B,B为CH3CH2OH,B被催化氧化生成C,C为CH3CHO,C被氧化生成D,D为CH3COOH,B、D发生酯化反应生成乙酸乙酯,乙烯发生加聚反应生成聚乙烯,
(1)乙酸乙酯分子式为C4H8O2,乙烯结构简式为CH2=CH2,故答案为:C4H8O2;CH2=CH2;
(2)反应①为i加成反应,D为乙酸,含有羧基,故答案为:加成反应;羧基;
(3)①乙烯和水加成反应生成乙醇,反应的方程式为CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;
②反应为乙醇的催化氧化,反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
③是乙醇和乙酸的酯化反应生成乙酸乙酯,反应方程式为C2H5OH+CH3COOH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;C2H5OH+CH3COOH CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
点评 本题考查有机物推断,为高频考点,侧重于学生的分析能力的考查,本题涉及烯、醇、醛、羧酸之间的转化关系等,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
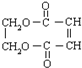
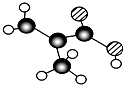 ,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).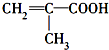 .
.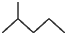 表示的有机物C的分子式为C6H14.
表示的有机物C的分子式为C6H14.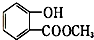 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离 子 | 要 求 |
| A | K+、AlO2-、Cl-、MnO4- | c(K+)<c(Cl-) |
| B | Fe3+、NO3-、I-、HCO3- | 逐滴加入盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、CH2COOH | 逐滴加入NaOH溶液立即有气体产生 |
| D | Na+、Cu2、Cl-、SO42- | 逐滴加氨水先有沉淀产生,后沉淀消失 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
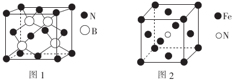
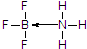 (标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.
(标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
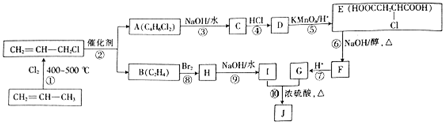
 .
. +3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.
+3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.
(1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
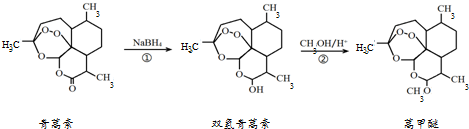
| A. | 青蒿素的分子式是C15H21O5 | |
| B. | 青蒿素在NaOH溶液中可以发生水解反应 | |
| C. | 反应②有H2O生成 | |
| D. | 青蒿素分子内的“-O-O-”基团可能对疟原虫有抑制作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1NaClO溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 25℃时,0.1 mol•L-1CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 已知酸性:HCOOH>CH3COOH,浓度均为0.1 mol•L-1的HCOOK与CH3COONa溶液中:c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com