
【题目】在某温度下,向三个初始体积均为1L的密闭容器中按下表所示投料,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)△H<0。达到平衡进,下列说法正确的是
2SO3(g)△H<0。达到平衡进,下列说法正确的是
容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的 物质的量/mol | ||
SO2 | O2 | SO3 | |||
Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
A. 平衡时SO3的物质的量:a>1.2、b>1.2
B. 容器Ⅱ、Ⅲ中平衡常数相同
C. 容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
D. 若起始时向容器Ⅰ中充入1.0molSO2(g)、0.40molO2(g)和1.40molSO3(g),则此时V正<V逆
【答案】AC
【解析】A.绝热恒容时,为SO3反应物,发生反应2SO3(g)![]() 2SO2(g)+O2(g)△H>0,正反应为吸热反应,温度降低,平衡向生成SO3的方向移动,a>1.2,反应2SO2(g)+O2(g)═2SO3为气体体积减小的反应,恒温恒压时,与原平衡相比相当于压强增大,平衡向生成SO3的方向移动,b>1.2,故A正确;B.平衡常数与温度有关,容器Ⅱ绝热温度会越来越高,容器Ⅲ恒温温度不变,所以容器Ⅱ、Ⅲ温度不同,平衡常数不同,故B错误;C.根据A分析,SO3的转化率减小,即容器 I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1,故C正确;D.容器 I中反应达到平衡状态时,c(SO3)=1.2mol/L,c(SO2)=
2SO2(g)+O2(g)△H>0,正反应为吸热反应,温度降低,平衡向生成SO3的方向移动,a>1.2,反应2SO2(g)+O2(g)═2SO3为气体体积减小的反应,恒温恒压时,与原平衡相比相当于压强增大,平衡向生成SO3的方向移动,b>1.2,故A正确;B.平衡常数与温度有关,容器Ⅱ绝热温度会越来越高,容器Ⅲ恒温温度不变,所以容器Ⅱ、Ⅲ温度不同,平衡常数不同,故B错误;C.根据A分析,SO3的转化率减小,即容器 I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1,故C正确;D.容器 I中反应达到平衡状态时,c(SO3)=1.2mol/L,c(SO2)=![]() mol/L=0.8mol/L,c(O2)=
mol/L=0.8mol/L,c(O2)=![]() mol/L=0.4mol/L,化学平衡常数K=
mol/L=0.4mol/L,化学平衡常数K=![]() =5.625,若起始时向容器Ⅰ中充入1.0mol SO2 (g)、0.40mol O2(g)和1.40mol SO3 (g),浓度商=
=5.625,若起始时向容器Ⅰ中充入1.0mol SO2 (g)、0.40mol O2(g)和1.40mol SO3 (g),浓度商=![]() =4.9<5.625,则该反应向正反应方向移动,则此时V正>V逆,故D错误;故选AC。
=4.9<5.625,则该反应向正反应方向移动,则此时V正>V逆,故D错误;故选AC。


科目:高中化学 来源: 题型:
【题目】2016年10月17日7点30分,神舟十一号载人飞船发射升空。制造航天飞船的主要材料是铝,工业上制铝时用冰晶石(Na3AlF6)做助熔剂,冰晶石制备流程有如下两种:
方案一:以纯碱和萤石(CaF2)为主要原料
![]()
方案二:以碳酸氢铵和六氟合硅酸为主要原料

(1)方案一中B可作为建筑材料,化合物A 是________,写出由C制备冰晶石的化学方程式____________________________。
(2)方案二中反应1产生的气体是_____________,反应2后滤液中主要成分的用途_________。
(3)方案二中反应2化学方程式________________________。
(4)工业电解制铝的阴极反应式为_________________,以石墨为电极维持电流180千安电解5小时生成铝270千克,则电流效率η(η=实际产量/理论产量)为_______。(法拉第常数F = 96500 C·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作错误的是( )
A. 滴定管经蒸馏水洗净后,即可注入标准液进行滴定
B. 玻璃导管蘸水后,边旋转边向橡皮管中插入
C. 滴定用锥形瓶经蒸馏水洗净后,不须用标准液润洗
D. 用玻璃棒蘸取待测液滴到pH试纸上,然后跟标准比色卡相对照,读出pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaCl中含有的Ca2+、Mg2+、SO42-、CO3-等离子,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl。加入试剂合理的操作顺序是( )
A.①②③④ B.③①②④ C.④②①③ D.③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生活动小组设计如图所示装置探究工业制硫酸接触室的反应,并测定此条件下二氧化硫的转化率。实验时,装置D锥形瓶中溶液产生白色沉淀,装置E中溶液褪色。

试填空:
(1)装置B有三个作用:除了通过观察气泡控制氧气和二氧化硫的速率和比例外,还可以_______和_____。
(2)实验过程中,当V2O5表面红热后,应将酒精灯移开一会儿后再继续加热,其原因是___________。
(3)D中锥形瓶中盛放的溶液可以是(选填序号)____
a、澄清石灰水 b、小苏打溶液 c、氯化钡溶液 d、硝酸钡溶液
反应停止后,要根据装置D锥形瓶中产生的白色沉淀的量,测定已被氧化的二氧化硫的量时,在滤出沉淀前必须进行的一步操作是____________________。
(4)若从锥形瓶溶液中得到的沉淀质量为mg,要测定该条件下SO2的转化率,实验时还需要测定的数据是(选填序号)______。SO2的转化率是_______(用含有m、a、b、c、d中的一种或几种字母的代数式表示)。
①装置F增加的质量ag ②装置A中亚硫酸钠减少的质量bg
③装置B增加的质量cg ④装置E增加的质量dg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石英、焦炭为原料的部分化工流程如图所示。

回答下列问题:
(1)反应I在工业上的作用是生产粗硅,为鉴定产品R中是否含有微量的铁单质,取少量R,用稀盐酸溶解,取上层清液后需再加入的试剂是______(填字母)。
a.碘水 b.氯水 c.KSCN溶液 d.NaCl溶液
(2)反应Ⅱ要在干燥环境下迸行,其原因是______;经冷凝得到的SiHCl3(沸点为33.0℃)中含有少量SiCl4沸点为57.6℃)和HC1(沸点为- 84.7℃),则提纯SiHCl3的方法为______________。
(3)将水蒸气通过灼热的煤粉可产生水煤气,其主要成分是CO、H2。工业上将水煤气液化后制得的CH3OH中含有的化学键类型为________(填“离子键”或“共价键”);流程图中的反应Ⅲ为氧化还原反应,其化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定。

(1)氢氧燃料电池能量转化的主要形式是_______(填“电能转化为化学能”或“化学能转化为电能”)。
(2)通入H2的电极为______(填“正极”或“负极”),该电极的电极反应式为____________。
(3)电极表面镀铂粉的原因是____________________。
(4)随着电池不断放电,电解质溶液的碱性________(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A. 1 mol NH5中含有5 NA个N﹣H键(NA表示阿伏加德罗常数)
B. NH5中既有共价键又有离子键
C. NH5的电子式为![]()
D. 它与水反应的离子方程式为NH4++H﹣+H2O=NH3H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO![]() 2CO2+N2。
2CO2+N2。
(1)写出CO2的结构式____________,N2的电子式___________。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
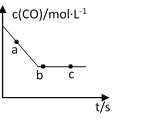
①则反应速率υ(a)、υ(b)、 υ(c)的大小关系是______________;
②下列可说明反应到达图中c点的是__________;
A.NO、CO、CO2、N2表示的速率比值保持2︰2︰2︰1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
D.容器中的气体质量或物质的量保持不变
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
【结论】①实验编号Ⅱ的实验目的为_________________________。
②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是___________,且____________反应速率将___________。(填“增大”、“减小”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com