
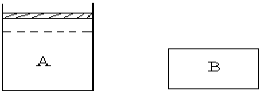
 有A、B两个容器,A为恒压容器,B为恒容容器.在相同温度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2.此时VA=2VB.维持温度不变,A、B中的反应均达到平衡.平衡时,两容器中反应放出的热量分别为QAkJ、QBkJ,A容器中气体体积为起始时的
有A、B两个容器,A为恒压容器,B为恒容容器.在相同温度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2.此时VA=2VB.维持温度不变,A、B中的反应均达到平衡.平衡时,两容器中反应放出的热量分别为QAkJ、QBkJ,A容器中气体体积为起始时的| 4 |
| 5 |
 2NH3
2NH3| 1-x+3-3x+2x |
| 1+3 |
| 4 |
| 5 |
| 2x |
| 4-2x |
| 0.8 |
| 3.2 |
 2NH3为体积减小的反应,所以恒压过程反应正向进行的程度要比恒容过程的大,放的热也就多,由于A容器中物质是B容器中物质的两倍且反应正向进行的程度大,所以有2QB<QA,根据N2(g)+3H2(g)
2NH3为体积减小的反应,所以恒压过程反应正向进行的程度要比恒容过程的大,放的热也就多,由于A容器中物质是B容器中物质的两倍且反应正向进行的程度大,所以有2QB<QA,根据N2(g)+3H2(g) 2NH3(g)△H=-Q kJ/mol可知,当1molN2、3molH2完全反应时可放出QkJ的热,而该反应为可逆反应,所以QA<Q,故答案为:2QB<QA<Q;
2NH3(g)△H=-Q kJ/mol可知,当1molN2、3molH2完全反应时可放出QkJ的热,而该反应为可逆反应,所以QA<Q,故答案为:2QB<QA<Q;


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| A、丙烯与氯化氢在一定条件下制取2-氯丙烷 |
| B、酒精与浓硫酸混合液迅速升温至170℃的反应 |
| C、甲烷制四氯化碳 |
| D、甲烷与氧气的混合气体在点燃下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
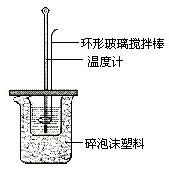 已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
 根据中和热的测定实验填空.
根据中和热的测定实验填空.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、氧化性(酸性溶液):Co(OH)3>FeCl3>I2 |
| B、还原性(酸性溶液):FeCl2>HI>HCl |
| C、酸性(水溶液):CH3COOH>H2CO3>HCN |
| D、热稳定性:NaCl>NaClO4>NaClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com