
| 实验要求 | 选项的标号 |
| (1)证明粗盐中含有少量CaCl2 | |
| (2)鉴别Na2SO4溶液和NaCl溶液 | |
| (3)检验氯化亚铁是否变质 | |
| (4)证明某地雨水溶液呈酸性 | |
| (5)除去FeCl2溶液中的少量FeCl3 | 1 |
分析 (1)氯化钙与碳酸钠反应生成白色沉淀,粗盐不能;
(2)Na2SO4溶液与氯化钡反应生成白色沉淀,而NaCl不能;
(3)变质混有铁离子,遇KSCN溶液为血红色;
(4)利用pH试纸测定酸性;
(5)Fe与氯化铁反应生成氯化亚铁.
解答 解:(1)氯化钙与碳酸钠反应生成白色沉淀,粗盐不能,则选择C证明;
(2)Na2SO4溶液与氯化钡反应生成白色沉淀,而NaCl不能,则选择A鉴别;
(3)变质混有铁离子,遇KSCN溶液为血红色,则选择E检验;
(4)利用pH试纸测定酸性,则选择B证明;
(5)Fe与氯化铁反应生成氯化亚铁,则选择D来除杂,
故答案为:
| 实验要求 | 选项的标号 |
| (1)证明粗盐中含有少量CaCl2 | C |
| (2)鉴别Na2SO4溶液和NaCl溶液 | A |
| (3)检验氯化亚铁是否变质 | E |
| (4)证明某地雨水溶液呈酸性 | B |
| (5)除去FeCl2溶液中的少量FeCl3 | D |
点评 本题考查物质的鉴别和检验及混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意元素化合物性质的应用,题目难度不大.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:推断题
 ;
;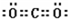 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.93g | B. | 3.51g | C. | 4.00g | D. | 5.85g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol | B. | 5.5 mol | C. | 3 mol | D. | 2.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 盐酸与碳酸钠溶液反应CO32-+2H+═CO2↑+H2O | |
| C. | 硝酸银溶液中加入铜粉Ag++Cu═Cu2++Ag | |
| D. | 铁与稀盐酸反应2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com