
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
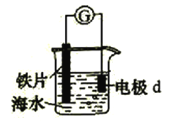
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+ 2H2O + 4e = 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++ 2e = H2↑
【答案】D
【解析】A、由于活动性:Fe>石墨,所以铁、石墨及海水构成原电池,Fe为负极,失去电子被氧化变为Fe2+进入溶液,溶解在海水中的氧气在正极石墨上得到电子被还原,比没有形成原电池时的速率快,选项A正确;B、d为石墨,由于是中性电解质,所以发生的是吸氧腐蚀,石墨上氧气得到电子,发生还原反应,电极反应为:O2 + 2H2O + 4e-→ 4OH–,选项B正确;C、若d为锌块,则由于金属活动性:Zn>Fe,Zn为原电池的负极,Fe为正极,首先被腐蚀的是Zn,铁得到保护,铁片不易被腐蚀,选项C正确;D、d为锌块,由于电解质为中性环境,发生的是吸氧腐蚀,在铁片上电极反应为:O2 + 2H2O + 4e-→ 4OH–,选项D错误。答案选D。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】室温下进行相关实验。下列结论正确的是
A.向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+c(CO32-)
B.向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)>c(Cl-)
C.向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH<13
D.将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中:c(Ag+)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。X是同周期中金属性最强的元素,五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位置是 。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的微粒间作用力的类型为 。
(4)Z的氢化物与W的一种氢化物发生反应可生成Z的单质,写出其化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
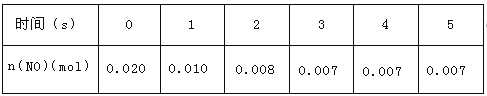
(1)下图表示NO2的变化曲线是_____。用O2表示从0-2s内该反应的平均速率v=____。
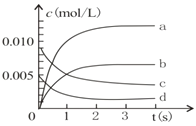
(2)能说明该反应己达到平衡状态的是_____(填字母序号,下同)。
a.v(NO2)=2v(O2)
b.容器内气体总物质的量保持不变
c.V逆(NO)=2v正(O2 )
d.容器内气体的密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是_____。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.锌与稀硫酸的反应既是氧化还原反应,又是 反应(填“放热”或“吸热”,实验室可将该反应设计成原电池,应采用 作为负极材料,正极的电极反应式为 ,若有1mol电子流过导线,理论上正极产生的气体在标准状况下的体积是 L。
II.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是 ;
(3)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
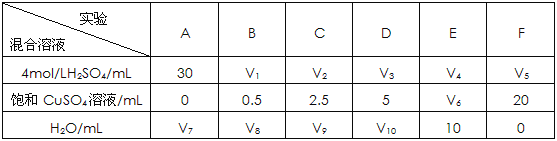
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示:

(1)写出反应I、II的化学方程式(不必写反应条件):
I、 ;II ;III、2HI![]() H2+I2
H2+I2
(2)整个过程中起到了催化作用的物质是 (写化学式)。
(3)一定温度下,向2L密闭容器中加入1molHI(g),发生反应III,生成的I2为气体,H2物质的量随时间的变化如图所示。则0-2min内的平均反应速率v(HI)= ,能作为该反应达到平衡状态判断依据的是 。
①n(H2)=n(I2) ②压强不再变化 ③气体密度不再变化
④2个H-I断裂的同时,有1个H-H断裂 ⑤各组分浓度保持不变
⑥c(HI):c(H2):c(I2)=2:1:1
(4)已知有关键能数据:I2-151kJ/mol、H2-436kJ/mol、HI-298kJ/mol,则当有0.2molHI分解时的能量变化是 (填“吸收”或“放出”) kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空。
(1)同温同压下烷烃A蒸气的密度是H2的15倍,烷烃A的分子式:______________;结构简式 。
(2)烷烃B的分子中含有200个氢原子,烷烃B的分子式:________。
(3)含有5个碳原子的烷烃D,烷烃D的分子式: ___________。
(4)分子中含有22个共价键的烷烃,烷烃的分子式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
(一)NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g)△H=+180.50kJmol-1
2NO(g)△H=+180.50kJmol-1
2CO(g)+O2(g)![]() CO2(g)△H=-566.00kJmol-1
CO2(g)△H=-566.00kJmol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参 与大气循环.写出该反应的热化学方程式___________________________;
(2)T℃时,将等物质的量的NO和CO充人容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化如下图所示.
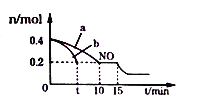
①T℃时该化学反应的平衡常数K=____________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将__________移动;(填“向左”、“向右”或“不”)
②图1中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是_______(填“a”或“b”)
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____________;
(二)SO2主要来源于煤的燃烧.燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关健。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是________________;
(4)如图所示的电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-。
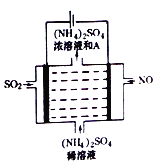
①写出物质A的化学式_________,阳极的电极反应式是________________;
②该电解反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月5日,从瑞典斯德哥尔摩传来令人振奋的消息:中国女科学家屠呦呦获得2015年诺贝尔生理学或医学奖。理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率。青蒿素的一种化学合成部分工艺流程如下:

已知:羰基![]() H可发生反应应
H可发生反应应![]()
回答下列问题:
(1)青蒿素的含氧官能团名称: 和过氧基;
(2)写出A发生加聚反应的化学方程式 ;
(3)反应B→C,实际上可看作两步进行,依次发生的反应类型是 ;
(4)写出由苯甲醛和氯乙烷为原料,制备苄基乙醛(![]() CH2CH2CHO)的合成路线流程图;无机试剂任用,合成路线流程图示例如下:CH3CH2OH
CH2CH2CHO)的合成路线流程图;无机试剂任用,合成路线流程图示例如下:CH3CH2OH![]() H2C=CH2
H2C=CH2![]() H2C Br-CH2 Br
H2C Br-CH2 Br
。
(5)写出E发生水解反应的化学方程式 。
(6)写出HC(OCH3)3只属于醇的同分异构体的结构简式(同一个碳原子上不能同时连接两个羟基) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com