
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 化学变化能够实现一种原子变为另一种原子 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
分析 A、丁达尔效应是胶体所特有的性质;
B、原子是化学变化中的最小微粒;
C、只由一种元素构成的纯净物为单质;
D、有固定原子组成的为纯净物.
解答 解:A、胶体有丁达尔效应,溶液没有丁达尔效应,可用丁达尔现象区分溶液与胶体,故A正确;
B、原子是化学变化中的最小微粒,化学变化能够实现一种分子变为另一种分子,核变化能够实现一种原子变为另一种原子属物理变化,故B错误;
C、O3是由3个氧原子构成的单质,不是化合物,故C错误;
D、CuSO4•5H2O是一种纯净物,不是混合物,D错误;
故选A.
点评 本题考查了化学中的基本概念和胶体的性质,应注意的是胶体的特性是能发生丁达尔效应,但胶体、溶液和浊液的本质区别是分散质粒子直径的大小.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数增大 | |
| D. | 通入CO2,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>D>A>B | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:Cn+>D(n+)->An+>B(n+)+ | D. | 单质还原性:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1molC2H4所含的电子数为12 NA | |
| B. | 标准状况下,16g甲烷中共价键数目为4NA | |
| C. | 常温常压,4 g氦气所含的核外电子数为4NA | |
| D. | 标准状况下,22.4L NO 与11.2L O2 充分反应后,所得的气体分子数一定为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
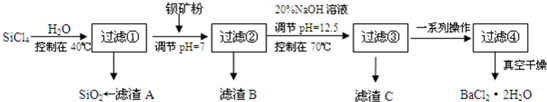
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牛肉 | B. | 辣椒 | C. | 鸡蛋. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com