
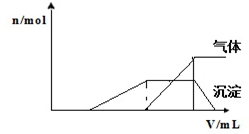
 1Lij�����Һ�����ܺ��е����������
1Lij�����Һ�����ܺ��е����������| ���ܴ������е������� | H+ NH4+ Al3+ K+ |
| ���ܴ������е������� | Cl- Br- I?ClO? AlO2- |
| Cl2���������״���� | 2.8L | 5.6L | 11.2L |
| n��X-�� | 1.25mol | 1.5mol | 2mol |
| n��Y-�� | 1.5mol | 1.4mol | 0.9mol |
| n��Z-�� | amol | 0 | 0 |
���� ��1�����ݲ�����������������ʵ�����n�������NaOH��Һ�������V���Ĺ�ϵ��ͼʾ����֪�����ռ�������������Һʱ��û�в���������֮������˳������ҳ�����ȫ�ܽ⣻�����ܽ�ǰ���������壬������һ���ǰ��������Ϸ������ݣ��ֱ�����Ӵ�����������жϣ�
��2���ٸ��ݷ�Ӧ��֪����Һ���������ܵ����ʵ������䣨�������������ӣ����ɱ������ݿ�֪��ͨ��5.6L����ʱ����������ȫ��Ӧ��ͬʱ����0.1mol�����ӣ��ݴ˼���a��ֵ��
��2.8L���������ʵ���=$\frac{2.8L}{22.4L/mol}$=0.125mol��ͨ��0.125mol����ʱ��Һ����I-������Br-û�вμӷ�Ӧ��������Һ��n��Br-��=1.5mol����Һ��������Ϊͨ���������ɵĺ�ԭ����Һ�д��ڵģ�����Clԭ���غ����ԭ��n��Cl-����5.6L���������ʵ���=$\frac{5.6L}{22.4L/mol}$=0.25mol��ͨ��0.25mol����ʱ��Һ��û��I-�����������ȫ��Ӧ����n��Br-��=1.4mol��˵����0.1mol�����Ӳμӷ�Ӧ�����������ȫ��Ӧ������ת�Ƶ�����ȼ���n��I-�����ݴ˷������
����Һ�����ͬ�������ʵ���֮�ȵ���Ũ��֮�ȣ�
��� �⣺����ͼʾ����ʼʱû�г������ɣ�˵����Һ�������ӣ�һ��û��ClO-��AlO2-�������ֳ������ҳ�����ȫ�ܽ��ˣ�˵��������������������Һ��һ�����������ӣ�һ��û��AlO2-�������������ܽ�ǰ���������壬������һ���ǰ���������Һ��һ����������ӣ�
��1������Һ��ȷ�����е�������H+��NH4+��Al3+������ȷ���Ƿ��е���������K+��Ҫȷ������ڿɲ�������ʵ����������ɫ��Ӧ�����ܲ����۲��Ƿ�Ϊ��ɫ��ȷ���Ƿ����ӣ�һ��������ClO-��AlO2-��
�ʴ�Ϊ��H+��NH4+��Al3+��K+����ɫ��Ӧ��ClO-��AlO2-��
��2��.2.8L���������ʵ���=$\frac{2.8L}{22.4L/mol}$=0.125mol��ͨ��0.125mol����ʱ��Һ����I-������Br-û�вμӷ�Ӧ��������Һ��n��Br-��=1.5mol����Һ��������Ϊͨ���������ɵĺ�ԭ����Һ�д��ڵģ�����Clԭ���غ��ԭ��n��Cl-��=1.25mol-0.125mol��2=1mol��
II.5.6L���������ʵ���=$\frac{5.6L}{22.4L/mol}$=0.25mol��ͨ��0.25mol����ʱ��Һ��û��I-�����������ȫ��Ӧ����n��Br-��=1.4mol��˵����0.1mol�����Ӳμӷ�Ӧ�����������ȫ��Ӧ������ת�Ƶ�����ȵ�n��I-��=0.25mol��2-0.1mol��1=0.4mol��
�ٸ��ݷ�Ӧ��֪����Һ���������ܵ����ʵ������䣨�������������ӣ����ɱ������ݿ�֪��ͨ��5.6L����ʱ����������ȫ��Ӧ��ͬʱ����0.1mol�����ӣ���a=1.75+1.4-��1.5+1.5��=0.15��
�ʴ�Ϊ��0.15��
�ڸ������Ϸ���֪����ͨ��Cl2�����Ϊ2.8Lʱ��ֻ�е����Ӻ�������Ӧ��������Һ�з�����Ӧ�����ӷ���ʽΪCl2+2I-=I2+2Cl-��
�ʴ�Ϊ��Cl2+2I-=I2+2Cl-��
��ͨ�����Ϸ���֪��n��Cl-��=1mol��n��Br-��=1.5mol��n��I-��=0.4mol����Һ�����ͬ�������ʵ���֮�ȵ���Ũ��֮�ȣ�����C��Cl-����C��Br-����C��I-��=1mol��1.5mol��0.4mol=10��15��4��
�ʴ�Ϊ��10��15��4��
���� ���⿼�����ӷ�Ӧ����ʽ�ļ��㣬��ȷ���ӷ�Ӧ�Ⱥ�˳���ǽⱾ��ؼ������ת�Ƶ����غ㡢ԭ���غ���������Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
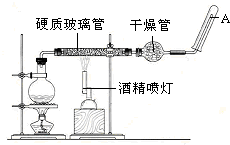 �ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ������װ�ã��Ϳ�����ɸ����¡�Fe��ˮ�����ķ�Ӧʵ�顱�������ʵ�飬֤����ԭ������ˮ�����ܹ�������Ӧ��
�ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ������װ�ã��Ϳ�����ɸ����¡�Fe��ˮ�����ķ�Ӧʵ�顱�������ʵ�飬֤����ԭ������ˮ�����ܹ�������Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X2Y3 | B�� | XY3 | C�� | X2Y2 | D�� | X3Y2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CuCl2 | B�� | CuSO4 | C�� | Cu��OH��2 | D�� | CuCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ԫ�� | B�� | ��Ԫ�� | C�� | ��Ԫ�� | D�� | þԪ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 �����з�Ӧ��-������ϳɹ��̣�����ijЩ��Ӧ���������ַ�Ӧ���������δע����
�����з�Ӧ��-������ϳɹ��̣�����ijЩ��Ӧ���������ַ�Ӧ���������δע����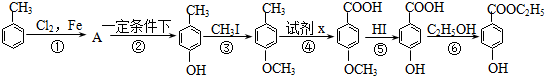 ����
����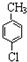 ��A������Ϊ���ȼױ���
��A������Ϊ���ȼױ���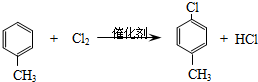 ��
��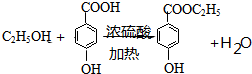 ��
�� ��ͬ���칹���У�������NaHCO3������Ӧ��������FeCl3��Һ������ɫ��Ӧ�Ĺ���13�֣����к˴Ź�������Ϊ5��壬�ҷ������Ϊ2��2��2��1��1��Ϊ
��ͬ���칹���У�������NaHCO3������Ӧ��������FeCl3��Һ������ɫ��Ӧ�Ĺ���13�֣����к˴Ź�������Ϊ5��壬�ҷ������Ϊ2��2��2��1��1��Ϊ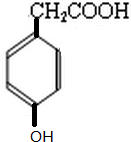 ��д�ṹ��ʽ����
��д�ṹ��ʽ����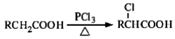 ��д���Ա��Ӻ��Ҵ�Ϊԭ���Ʊ�
��д���Ա��Ӻ��Ҵ�Ϊԭ���Ʊ�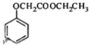 �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼ�����£�
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼ�����£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 20��ʱ����пƬ����0.01 mol•L-1��ϡ������ | |
| B�� | 20��ʱ����пƬ����0.1 mol•L-1��ϡ������ | |
| C�� | 50��ʱ����пƬ����0.01 mol•L-1��ϡ������ | |
| D�� | 50��ʱ����пƬ����0.1 mol•L-1��ϡ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com