
【题目】下列说法正确的是( )
A. 物质的量是表示物质所含微观粒子多少的一个物理量
B. 物质的量的单位——摩尔,只适用于分子、原子和离子
C. 摩尔只能用来计量纯净物中微观粒子的数目
D. 摩尔不能用来计量混合气体中分子的数目
科目:高中化学 来源: 题型:
【题目】总的物质的量为0.50mol的Fe粉与Al粉混合物分为等质量的两份;在一份中加入足量的稀盐酸,在标准状况下产生气体aL;在另一份中加入足量的氢氧化钠溶液,在标准状况下产生气体bL。则a+b的数值不可能是( )
A. 5.6 B. 7.3 C. 8.2 D. 11.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:为使空气质量达标,完成二氧化硫,氮氧化物排放量下降的目标,离不开各种化学处理方法。一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO3(g)△H=-296kJ·mol-1
SO3(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是___________________。
Ⅱ:如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
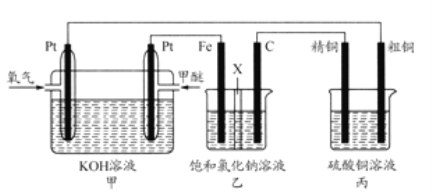
(1)甲醚燃料电池的负极反应式____________。
(2)石墨电极(C)的电极反应式为____________________________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____________(填“增大”“减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为____________;则乙装置中生成标况下气体的体积为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:

(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:烧杯、托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是______________。
(2)写出步骤①中发生反应的离子方程式___________
(3)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?________。若合理,请用离子方程式解释其原因_________________________________(若你认为不合理,该空不作答)。

II.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:_____________________________
(2)实验②的化学反应中转移电子的物质的量是_______________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:akJmol-1、P-O:bkJmol-1、P=O:ckJmol-1、O=O:dkJmol-1.根据图示的分子结构和有关数据估算1mol白磷反应放出的热量,其中正确的是
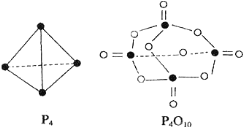
A. (6a+5d-4c-12b)kjB. (4c+12b-6a-5d)kJ
C. (4c+12b-4a-5d)kJD. (4a+5d-4c-12b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4) 是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行(因在温度较高时KOH 与Cl2 反应生成的是KClO3。)写出①的化学方程式_____________________。
(2)在溶液I中加入KOH 固体的目的是_____________________。(填编号)
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH 固体溶解时会放出较多的热量,有利于反应进行
C.为下一步反应提供碱性的环境
D.使KClO3 转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4 后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为__________________________________________。
(4)如何判断K2FeO4 晶体已经洗涤干净___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的恒容密闭容器中充入6molCO2 和8molH2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
CH3OH(g)+H2O(g) △H= -49.0kJmol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是
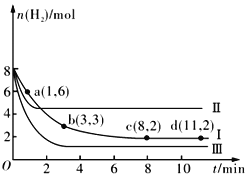
A. 该反应在0~8 min内CO2 的平均反应速率是0.375mol·L-1·min-1
B. 保持温度不变,若起始时向上述容器中充入4molCO2、2molH2、2molCH3OH(g)和1mol H2O(g),则此时反应向正反应方向进行
C. 保持温度不变,若起始时向上述容器中充入3molCO2 和4molH2,则平衡时H2 的体积分数等于20%
D. 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 ,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )
A. 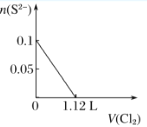 B.
B. 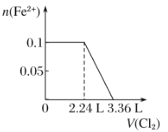 C.
C. 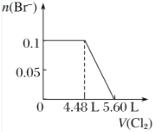 D.
D. 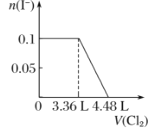
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com