
【题目】15.3 g Mg-Al合金(无其他成分),加入到500 mL稀硝酸中,恰好完全反应后,共收集到标准状况下的NO气体11.2 L,向所得溶液中加入4 mol/L NaOH溶液400 mL,得到白色沉淀。下列叙述中正确的是
A.合金中,m(Mg):m(Al)=1:1
B.原稀硝酸的物质的量浓度与NaOH溶液相同
C.白色沉淀的成分为Mg(OH)2
D.过滤后,向白色沉淀中加入原稀硝酸250 mL,可将沉淀全部溶解
【答案】B
【解析】
该反应中发生反应有:![]() 、
、![]() ;
;
A.HNO3转化成NO,转移了3mole-,到标准状况下的NO气体11.2 L,则转移的电子数为:![]() ,15.3 g Mg-Al合金加入到稀硝酸中,发生反应:
,15.3 g Mg-Al合金加入到稀硝酸中,发生反应:![]() 、
、![]() ,设Mg的物质的量为xmol、Al的为ymol,则24x+27y=15.3,根据得失电子相等,则2x+3y=1.5,解得x=0.3mol、y=0.3mol,则合金中,m(Mg):m(Al)=1mol×24g/mol:1mol×27g/mol=8:9,A错误;
,设Mg的物质的量为xmol、Al的为ymol,则24x+27y=15.3,根据得失电子相等,则2x+3y=1.5,解得x=0.3mol、y=0.3mol,则合金中,m(Mg):m(Al)=1mol×24g/mol:1mol×27g/mol=8:9,A错误;
B.根据反应方程式可知,硝酸的物质的量为![]() ,则原硝酸的浓度为
,则原硝酸的浓度为![]() ,与NaOH溶液相同,B正确;
,与NaOH溶液相同,B正确;
C.![]() ,向反应后的溶液中加入过量NaOH溶液至沉淀完全发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Al(NO3)3+3NaOH=Al(OH)3↓+3NaNO3,全部沉淀需NaOH的物质的量为0.3mol×2+0.3mol×3=1.5mol,过量的NaOH为0.1mol,与0.1molAl(OH)3反应生成偏铝酸钠,则生成沉淀为0.3molMg(OH)2和0.1molAl(OH)3,C错误;
,向反应后的溶液中加入过量NaOH溶液至沉淀完全发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Al(NO3)3+3NaOH=Al(OH)3↓+3NaNO3,全部沉淀需NaOH的物质的量为0.3mol×2+0.3mol×3=1.5mol,过量的NaOH为0.1mol,与0.1molAl(OH)3反应生成偏铝酸钠,则生成沉淀为0.3molMg(OH)2和0.1molAl(OH)3,C错误;
D.沉淀溶解需要稀硝酸:Mg(OH)2溶解需稀硝酸0.3mol×2=0.6mol,Al(OH)3溶解需要稀硝酸0.1mol×3=0.3mol,溶液中的NaAlO2需要硝酸0.1mol×4=0.4mol,则需要稀硝酸共1.3mol,体积为![]() ,D错误;
,D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】(1)用系统命名法命名下列物质
①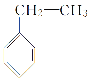 ______________;
______________;
②CH3CH2CH=CHCH3____________。
(2)写出结构简式或名称:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃的结构简式_____________。
②戊烷(C5H12)的某种同分异构体只有一种一氯代物,写出该戊烷的名称__________。
(3)![]() CH2-CH=CH-CH2
CH2-CH=CH-CH2![]() 是一种加聚产物,则其单体的结构简式为___________,其链节为______________。
是一种加聚产物,则其单体的结构简式为___________,其链节为______________。
(4)请写出分子式为 C4H8O2属于酯类的同分异构体的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是石油裂解气的重要成分,由M制备环酯P的合成路线(部分反应条件略去)如图所示:

已知在特殊催化剂的作用下,能够发生碳碳双键两边基团互换的反应,如:
2CH2=CHR![]() CH2=CH2+RCH=CHR
CH2=CH2+RCH=CHR
回答下列问题:
(1)M的名称是____________,A中的含氧官能团名称是____________。
(2)①的反应类型是___________,⑥的反应类型是________________。
(3)C的结构简式为____________。由C→G的过程中步骤④、⑥的目的是___________。
(4)G中最多有_______个原子共平面,其顺式结构式为_____________。
(5)符合下列条件D的同分异构体有______种。
①氯原子连在碳链的端点碳上 ②羟基连在不同的碳原子上,其中核磁共振氢谱为4组峰且峰面积比为4:2:2:1的为__________(写结构简式)。
(6)由I和G在一定条件下制取环酯P的化学方程式为_________________。
(7)已知:  根据题中信息,设计以2-氯丙烷制备环己烯的合成路线(无机试剂和溶剂任选)___________。
根据题中信息,设计以2-氯丙烷制备环己烯的合成路线(无机试剂和溶剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为H2(g)和O2(g)生成H2O(g)过程中的能量变化。下列叙述中正确的是

A.该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol O(g)原子结合成O2(g)时,吸收498kJ能量
C.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(g)时,放热245kJ
D.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(l)时,释放的热量小于245kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W是合成一种抗心律失常药物的中间物质,一种合成该物质的路线如下:

(1)ClCH2CH2C1的名称是____________。
(2)E中不含氧的官能团的名称为____________。
(3)C的分子式为__________,B→C的反应类型是____________。
(4)筛选C→D的最优反应条件(各组别条件得到的D的产率不同)如下表所示:
组别 | 加料温度 | 反应溶剂 | AlCl3的用量(摩尔当量) |
① | -30~0℃ |
| 1 eq |
② | -20~-10℃ |
| 1 eq |
③ | -20~-10℃ | ClCH2CH2Cl | 1 eq |
上述实验筛选了________和________对物质D产率的影响。此外还可以进一步探究___________对物质D产率的影响。
(5)M为A的同分异构体,写出满足下列条件的M的结构简式:__________________。
①除苯环外不含其他环;②有四种不同化学环境的氢,个数比为1:1:2:2;③1 mol M只能与1mol NaOH反应。
(6)结合上述合成路线,写出以![]() 、CH3I和SOCl2为基本原料合成
、CH3I和SOCl2为基本原料合成![]() 的路线图。(其他所需无机试剂及溶剂任选)
的路线图。(其他所需无机试剂及溶剂任选)
已知,RCOOH![]() RCOCl。
RCOCl。
____________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:

步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是______.实验中不能用干燥空气代替干燥N2,原因是______________
(2)如将装置B改为装置C(图2),可能会导致的后果是___________________
(3)步骤3中,第一次过滤除去的物质是_________________.
(4)有关步骤4的说法,正确的是__________________.
A、可用95%的乙醇代替苯溶解粗品
B、洗涤晶体可选用0℃的苯
C、加热至160℃的主要目的是除去苯
D、该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2﹣①滴定管洗涤前的操作是_____________________________.
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500molL﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是__________________(以质量分数表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨![]() 液氧燃料电池原理示意如图,下列有关该电池说法正确的是
液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A.该电池工作时,每消耗22.4LNH3转移3mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,OH-向电极B移动
D.电极B上发生的电极反应为: ![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂离子电池,放电时电池反应为2Li+MgH2=Mg+2LiH,装置如图所示。下列说法不正确的是:
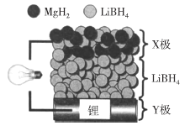
A.放电时,化学能只转化为电能B.放电时,X极的反应式为MgH2+2e-=Mg+2H-
C.充电时,Li+向Y极迁移D.充电时,理论上转移0.2NA个电子Y极增重1.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com