
����Ŀ���г����۵�ij��ʳ�þ����ΰ�װ����������˵����
��Ʒ�� | GB5461 |
��Ʒ�ȼ� | һ�� |
���� | ʳ�Ρ�����ء������ |
�⺬������I�ƣ� | 20��50mg/kg |
��װ���� | |
��װ��ҵ |
��1���������⻯�������������·������·�Ӧ��
kI O3+5KI+3H2 SO4=3K2 SO4+3I2+3H2O
������Ӧ���ɵ�I2�������Ȼ�̼���飺ȷ����I2���ɵ�������
����Na2SO3ϡ��Һ����I2��ԭ���ɴӵ�����Ȼ�̼��Һ�л������Ȼ�̼��Na2SO3ϡ��Һ��I2��Ӧ�����ӷ���ʽΪ ��
��2����֪��I2+2S2O32��=2I-+S4O62��ijѧ���ⶨʳ�þ����εĵ⺬�����䲽��Ϊ��
a��ȷ��ȡw gʳ�Σ�����������ˮʹ����ȫ�ܽ⣺
b����ϡ�����ữ������Һ����������KI��Һ��ʹKIO3��KI��Ӧ��ȫ��
c���Ե�����ҺΪָʾ������μ������ʵ���Ũ��Ϊ2.0��10��3mol/L��Na2S2O3��Һ10.0mL��ǡ�÷�Ӧ��ȫ��
���ж�c��ǡ����ȫ��Ӧ���ݵ������� ��
��3����b�з�Ӧ��������I2�����ʵ����Ƕ��٣���д��������̣�
��4���۸�������ʵ��Ͱ�װ��˵����þ����εĵ⣨I���������Ժ�w�Ĵ���ʽ��ʾ����λΪmg/kg������д��������̣�
���𰸡�
��1��CCl4�����ɫ��I2+SO32��+H2O=2I-+SO42��+2H+
��2�������һ����Һ������ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ
��3���⣺b�����ɵĵ���c�з�ӦI2+2S2O32���T2I-+S4O62��������
I2 ������������2S2O32����
1mol 2mol
1.0��10��5mol 2.0��10��3molL��1��0.0025L�� ![]() =2.0��10��5mol��
=2.0��10��5mol��
��b�з�Ӧ��������I2�����ʵ���Ϊ1.0��10��5
��4���⣺����KIO3+5KI+3H2SO4�T3K2SO4+3I2+3H2O��֪
I | KIO3 | 3I2 | |
������еĵ� | 127g | 3mol | |
m | 1.0��10��5mol |
����m= ![]() ��10��5g��
��10��5g��
������ÿǧ��ʳ���к��� ![]() ��
�� ![]() ��10��5g=
��10��5g= ![]() g=
g= ![]() mg��
mg��
��Ϊ ![]() mg/kg����þ����εĵ⣨I������Ϊ
mg/kg����þ����εĵ⣨I������Ϊ ![]() mg/kg
mg/kg
���������⣺��1��I2�����Ȼ�̼���ܽ�ȴ���ˮ�У��������Ȼ�̼���Ϻ�ɫ��ȷ����I2���ɵ�������CCl4�����ɫ��Na2SO3ϡ��Һ��I2��ӦNa2SO3ϡ��Һ���л�ԭ�Ա�����Ϊ�����ƣ�I2���������ԣ�����ԭΪI�� �� ��Ϸ�Ӧ�ĵ���غ��ԭ���غ���ƽд�����ӷ���ʽ��Na2SO3ϡ��Һ��I2��Ӧ�����ӷ���ʽ�ǣ�I2+SO32��+H2O=2I��+SO42��+2H+ �� ���Դ��ǣ�CCl4�����ɫ��I2+SO32��+H2O=2I��+SO42��+2H+����2���ٵ������۱���ɫ��������Һ����ɫ���淴ӦI2+2S2O32��=2I��+S4O62�����У���Һ��û�е⣬��Һ����ɫΪ��ɫ��˵����Ӧ���յ㣬�ж�c�з�Ӧǡ����ȫ�����ݵ������ǣ������һ����Һ������ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ�����Դ��ǣ������һ����Һ������ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ��


 ���ݼ���ϵ�д�
���ݼ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. �����Է����е�������ԭ��Ӧ��ͨ��ԭ��ص�װ�þ���ʵ��
B. ������ֳƶ��ε�أ�����ʱ�ķ�Ӧ�Ƿŵ�ʱ�ķ�Ӧ�������
C. ���ӵ�ز�������G��������ԭ���������ӵ���Դ���ޣ��۸�
D. ȼ�ϵ����һ�ָ�Ч�������Ѻõķ���װ�ã������������ʿɴ�100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�ʵ����Ϣ���£�
ʵ���� | c(HA)/mo1��L��1 | c(NaOH)/mo1��L��1 | ��Ӧ����ҺpH |
�� | 0.1 | 0.1 | pH=9 |
�� | c1 | 0.2 | pH=7 |
�����жϲ���ȷ����
A. 0.1 mo1��L��1��HA��Һ����ˮ�������c(H+)=1��l0��13mo1/L
B. c1һ������0.2 mo1��L��1
C. ��Ӧ�����Һ�У�HAռ��A��������0.02%
D. �ҷ�Ӧ�����Һ�У�c(Na+)��c(HA)+c(Aһ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ԭ��ز����ĵ�ѹ������ǿ�Ⱦ��������⡢���Ҫ��Ϊ���뻯��������Ϊ��װ���еĵ缫��š�����˵���������
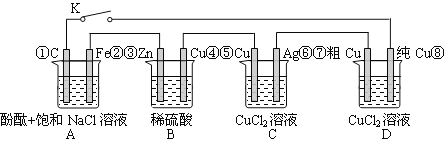
A����K�պ�ʱ��Aװ�÷���������ʴ���ڵ�·������Դ
B����K�Ͽ�ʱ��Bװ��пƬ�ܽ⣬����������
C����K�պϺ�������·�е��ӵ���������Ϊ������������������������������
D����K�պϺ�A��Bװ����pH���C��Dװ����pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֹ⻯ѧ��صĽṹ��ͼ��ʾ������ܷ�ӦΪAgCl(s)��Cu��(aq)===Ag(s)��Cu2��(aq)��Cl��(aq)�����й��ڸõ���ڹ���ʱ��˵������ȷ����(����)
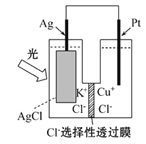
A. Cl���ɸ���Ǩ�Ƶ�����
B. ���������ʷ�����ԭ��Ӧ
C. Cu���ڸ�������������Ӧ
D. ����108 g����ת�Ƶ��Ӹ���Ϊ1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO�ϳɼ״�(CH3OH)�Ļ�ѧ��Ӧ����ʽΪCO(g)+2H2(g)![]() CH3OH(g) ��H < 0��������ͬ�����ʵ���Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
CH3OH(g) ��H < 0��������ͬ�����ʵ���Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. ����Ӧ���ʣ�v(a)>v(c) v(b)>v(d)
B. ƽ��ʱa��һ����n(CO):n(H2)��1:2
C. ƽ�ⳣ����K(a)>K(c) K(b)��K(d)
D. ƽ��Ħ��������![]() (a)<
(a)<![]() (c)
(c)![]() (b)>
(b)>![]() (d)
(d)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�г�Na+�⣬������SO42����HCO3����SO32����Br�������ӣ�ͨ������Cl2����Һ������Ũ���������
A. SO42�� B. HCO3�� C. SO32�� D. Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��� SO2 �ȴ����к������ʣ���������ķ����ж��֣�����ʯ��ʯ�����������յ���Ҫ��Ӧ����:
��CaCO3(s)![]() CO2(g)+CaO (s) ��H = + 178.2 kJ/mol
CO2(g)+CaO (s) ��H = + 178.2 kJ/mol
��SO2(g)+CaO(s)![]() CaSO3(s) ��H = - 402 kJ/mol
CaSO3(s) ��H = - 402 kJ/mol
�� 2CaSO3(s) + O2 (g) + 4H2O(l)![]() 2[CaSO4�� 2H2O](s) ��H = - 234.2 kJ/mol
2[CaSO4�� 2H2O](s) ��H = - 234.2 kJ/mol
��1����д����ʯ��ʯ����������������ˮ��Ӧ������ʯ����Ȼ�ѧ����ʽ________________________________________________________
��2����Ӧ��Ϊ��������Ĺؼ���ȡ��ͬ�����ķ�Ӧ����3�ֲ�ͬ�������н��и÷�Ӧ��A�������ֺ��º�ѹ��B�������ֺ��º��ݣ�C�������ֺ��ݾ��ȣ��ҳ�ʼʱ3���������ݻ����¶Ⱦ���ͬ������˵����ȷ����_______________
a��3��������SO2��ƽ��ת���ʵĴ�С˳��Ϊ����A > ��B > ��C
b����A�����������ƽ��Ħ����������ʱ��˵���÷�Ӧ���ڻ�ѧƽ��״̬
c��A��B���������ﵽƽ�����õ�ʱ�䣺tA > tB
d���� C ������ƽ�ⳣ������ʱ��˵���÷�Ӧ���ڻ�ѧƽ��״̬
��3������������Ӧ��������һ����������ѹ����һ�� 20 L�������У���ò�ͬ�¶��£������� SO2 ��������mg�����±���
ʱ��/min SO2����/mg �¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
T2 | 2100 | 869 | 242 | x | x | x | x |
����T1�¶��£�����20��40min��SO2 �ķ�Ӧ����____________mol/(L�� min)��
����������������ͬ����T1______T2������>���� ��<�� �� ��=������ͬ���� x _____ 0.06��
����T2�¶��£���ƽ����������ݻ�ѹ��Ϊ10 L������ƽ��ʱSO2��Ũ��_____ԭƽ��ʱSO2��Ũ�ȣ�����>���� ��<�� �� ��=������������________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У��������ȷ�Ӧ���ǣ� ��
A. ȼ��CO B. NaOH��Һ��ϡ���ᷴӦ
C. ����ϡ���ᷴӦ D. Ba(OH)28H2O�����NH4Cl���巴Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com