
| A. | 高温有利于提高反应的转化率 | |
| B. | 高温可增大反应的限度 | |
| C. | 700K时反应催化剂活性最强,反应速率更快 | |
| D. | 高温才可以自发向右进行 |
分析 根据温度对反应速率、化学平衡及催化剂的影响分析,升高温度加快反应速率,合成氨的反应是放热反应,升温使平衡向吸热方向移动,不利于平衡正向进行和氨气的产量,但此温度下反应速率较大,经济效益较好,催化剂在此温度下的活性最大,据此分析.
解答 解:N2+3H2?2NH3 △H<0,该反应是放热的可逆反应,要使平衡向正反应方向移动,应降低温度,但温度过低反应速率过小,不利于工业生成效益;温度越高,反应速率越大,所以应适当升高温度,使反应速率增大;使用催化剂也能增大反应速率,但在700K左右时催化剂的活性最大,所以选择采用700K左右的温度,
A.反应是放热反应,升温平衡逆向进行,反应物转化率降低,不利于提高反应的转化率,故A错误;
B.分析可知低温可以增大反应的限度,故B错误;
C.在700K左右时催化剂的活性最大,同时保证了反应具有一定的反应速率,提高了经济效益,故C正确;
D.反应△H<0,△S<0,满足△H-T△S<0反应才能自发进行,则需要在低温下可以自发向右进行,故D错误;
故选C.
点评 本题考查化学平衡知识,合成氨的生产条件选择和平衡移动原理的应用,侧重于化学与生产的关系的考查,有利于培养学生的良好科学素养和提高学习的积极性,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠可作胃酸的中和剂 | B. | SiO2可用于制造太阳能电池 | ||
| C. | 铁经常用作红色油漆和涂料 | D. | 生石灰用作食品抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R与Z形成的是共价化合物 | |
| B. | 原子半径:W>R>Z | |
| C. | W的气态氢化物的热稳定性比Y的弱 | |
| D. | R的最高价氧化物的水化物酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,减小容器体积,平衡不移动 | |
| B. | 其他条件不变,增大c(A),A的转化率增大 | |
| C. | 降低温度,v正增大,v逆减小 | |
| D. | v正(A)═2v逆(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
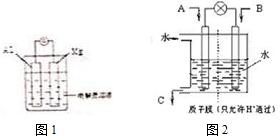 电能与化学能之间的转化具有重要的使用价值.
电能与化学能之间的转化具有重要的使用价值.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 (25℃) | Ka=1.75ⅹ10-5 | Ka=2.98ⅹ10-8 | Ka1=4.3ⅹ10-7 Ka2=5.61ⅹ10-11 | Ka1=1.54ⅹ10-2 Ka2=1.02ⅹ10-7 |
| A. | 少量的CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO | |
| B. | 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| C. | 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:n (HCl)=1 mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 | |
| B. | 图2:n (NaOH)=1 mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| C. | 图3:n (O2)=1 mol,高温下C和O2在密闭容器中的反应产物 | |
| D. | 图4:n (HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com