
分析 (1)金属钠可以和水以及空气中的成分:氧气、氮气、二氧化碳之间反应,据此回答;
(2)发生反应:反应2Na2S+2O2+H2O=Na2S2O3+2NaOH,含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂;
(3)NaClO在碱性条件下跟NaCN反应生成氮气;双氧水将废水中的CN-氧化成无毒的物质;
(4)根据电子数相同解题;配置H2O2溶液的浓度时定容俯视刻度线,则双氧水溶液的体积偏小,则浓度偏高.
解答 解:(1)金属钠可以和水以及空气中的成分:氧气、氮气、二氧化碳之间反应,件数钠着火,可以用沙土扑灭,故答案为:C;
(2)发生反应:2Na2S+2O2+H2O=Na2S2O3+2NaOH,反应中O2中O化合价降低,所以O2为氧化剂,Na2S中S元素的化合价升高,为还原剂,该反应中氧化剂与还原剂的物质的量之比为1:1,
故答案为:1:1;
(3)NaClO在碱性条件下跟NaCN反应生成氮气,反应的离子反应方程式:2OH-+2CN-+5ClO-=2CO32-+5Cl-+H2O+N2↑;双氧水将废水中的CN-氧化成无毒的物质,得到CN-被氧化后的产物为HCO3-(或CO32-)、N2,故答案为:2OH-+2CN-+5ClO-=2CO32-+5Cl-+H2O+N2↑;HCO3-;
(4)与H2O2分子具有相同电子数的三原子化合物分子为H2S;配置H2O2溶液的浓度时定容俯视刻度线,则双氧水溶液的体积偏小,则浓度偏高,故导致测定后的浓度偏高,故答案为:H2S;偏大.
点评 本题考查了反应热和反应方程式的书写和中和滴定的相关知识及误差分析,注意知识的归纳和梳理是关键,难度中等.


科目:高中化学 来源: 题型:选择题
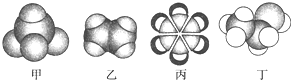
| A. | 甲能使酸性高锰酸钾溶液褪色 | |
| B. | 乙可与溴水发生加成反应使溴水褪色 | |
| C. | 丙中的碳碳键是碳碳单键和碳碳双键交替结合 | |
| D. | 丁不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸层析法通常以滤纸作为惰性支持物.滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 | |
| B. | 重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越小 | |
| C. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| D. | 在牙膏的浸泡液中加入新制碱性Cu(OH)2,溶液变绛蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
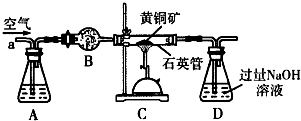

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成白色沉淀 | |
| B. | 生成红褐色沉淀 | |
| C. | 有气泡产生 | |
| D. | 先生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
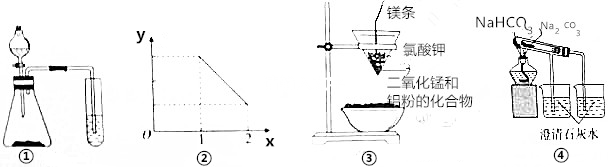
| A. | 用图①装置可比较硫酸、碳酸、硅酸三者的酸性强弱 | |
| B. | 图②表示NO2溶于水完全转化为HNO3时,水(x)与消耗氧气的物质的量(y)之间 关系 | |
| C. | 图③装置可制得金属锰 | |
| D. | 图④装置可验证NaHCO3和NaCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com