
| V |
| Vm |
| m |
| M |
| N |
| NA |
| 1.7g |
| 17g/mol |
| 0.448L |
| 22.4L/mol |
| 1.28g |
| 0.02mol |
| 6.72L |
| 22.4L/mol |
|


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Na+、I-、NO3-、SO42- |
| B、氢氧化铁胶体中:H+、K+、Cl-、S2- |
| C、在pH=0的溶液中:Na+、NH4+、NO3-、Cl- |
| D、水电离产生的c(H+)=1×10-12mol?L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 | ||||||||
| 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
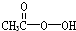 )是广为使用的消毒剂.它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2.测定产品中过氧乙酸浓度c0.涉及下列反应:
)是广为使用的消毒剂.它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2.测定产品中过氧乙酸浓度c0.涉及下列反应: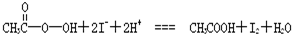
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、至少存在4种离子 |
| B、Cl-一定存在,且c(Cl-)≥0.4mol/L |
| C、SO42-、NH4+、一定存在,Cl-可能不存在 |
| D、CO32-、Al3+一定不存在,K+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Na+的基态电子排布图是: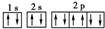 |
B、H2O分子的电子式为: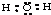 |
| C、Ca2+离子基态电子排布式为:1s22s22p63s23p6 |
D、氯原子结构示意图为: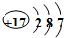 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com