
下列各组离子在指定溶液中能大量共存的是
A.加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
B.由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
C.有较多Fe3+的溶液中: Na+、NH4+、SCN-、HCO3-
D.酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
 习题精选系列答案
习题精选系列答案科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(文)试卷(解析版) 题型:填空题
下表是某食品包装上的说明,表中列出了部分配料。配料中,富含维生素的是 (填序号,下同),属于着色剂的是 ,属于防腐剂是 ,属于调味剂的是 。
品 名 | 浓苹果汁 |
配 料 | ① 浓缩苹果汁 ② 蔗糖 ③ 柠檬黄 ④ 山梨酸钾 |
果汁含量 | ≥80% |
生产日期 | 标于包装封口处 |
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(理)试卷(解析版) 题型:实验题
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol/L的MgCl2溶液中各加入10滴2 mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号 | 加入试剂 | 实验现象 |
Ⅰ | 4 mL 2 mol/L NH4Cl 溶液 | 沉淀溶解 |
Ⅱ | 4 mL蒸馏水 | 沉淀不溶解 |
(1)测得实验Ⅰ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因 。
(2)同学们猜测实验Ⅰ中沉淀溶解的原因有两种:
猜想1:氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水.
猜想2: 。
(3)为验证猜想,又设计了以下实验
序号 | 实验内容 | 结 果 |
1 | 测定醋酸铵溶液的pH | pH约为7,溶液呈中性 |
2 | 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 | 固体均溶解 |
①用醋酸铵溶液与氢氧化镁反应的原因是 。
②实验证明猜想正确的是 (填“1”或“2”)。
(4)实验Ⅱ观察到沉淀不溶解。该实验的目的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
在不同条件下分别测得反应2SO2+O2 2SO3的化学反应速率,其中表示该反应进行得最快的是
2SO3的化学反应速率,其中表示该反应进行得最快的是
A.v (SO2)=4mol/(L·min) B.v (SO2)=0.1mol/(L·s)
C.v (O2)=3mol/(L·min) D.v (O2)=0.1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高二上学期第二次月考化学试卷(解析版) 题型:填空题
已知A(g)+B(g) 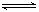 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的 △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率会 (填“变大”、“变小”或“不变”)
(3)若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
a.单位时间里生成B和D的物质的量相等
b.气体的密度不随时间改变
c.容器内压强保持不变
d.混合气体的平均摩尔质量保持不变
(4)1200 ℃时反应C(g)+D(g) 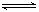 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高一上学期期末质量检测化学试卷(解析版) 题型:填空题
(7分)海藻中富含碘元素。某小组同学在实验室里用灼烧海藻的灰分提取碘,流程如下图。
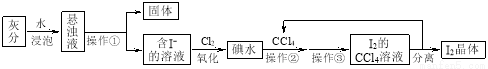
(1)写出操作名称:操作① ,操作③ 。
(2)用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4。有关化学方程式为:
碱性条件,3I2+6NaOH=5NaI+NaIO3+3H2O,
酸性条件,5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+H2O。
以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的 (填仪器名称)中加入少量1mol·L-1 NaOH溶液;
②振荡至溶液的 色消失,静置、分层,则 (填“上”、“下”)层为CCl4;
③将含碘的碱溶液从仪器的 (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1 mol·L-1 H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体;
(3)本实验中可以循环利用的物质是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高一上学期期末质量检测化学试卷(解析版) 题型:选择题
根据反应式:①2Fe3++2I- 2Fe2++I2 和② Br2+2Fe2+
2Fe2++I2 和② Br2+2Fe2+ 2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:填空题
(18分)依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池,如图所示。请回答下列问题:

(1)电极X的材料是________;电解质溶液Y是________溶液。(填名称)
(2)银电极为电池的________极,发生的电极反应为____________________________;X电极上发生的电极反应为____________________________。
(3)外电路中的电子是从________极流向______极(填电极材料)。外电路中每通过0.1 mol电子,银电极的质量理论上增加 g。
(4)原电池工作时,盐桥(装有琼脂-KCl的U型管)里的Cl-移向 电极。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
某一元弱酸HA的相对分子质量为M。在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg·cm-3,其中n(A-)为b mol。下列叙述,错误的是
A.溶液中c(H+) =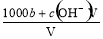
B.物质的量浓度c(HA) =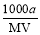 mol·L-1
mol·L-1
C.t℃时,HA的溶解度S =
D.HA的质量分数w(HA) =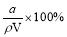
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com