
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )| A. | 2:3 | B. | 1:3 | C. | 3:2 | D. | 2:1 |
分析 发生反应有:Al3++3OH-=Al(OH)3、Mg2++2OH-=Mg(OH)2、Al(OH)3+OH-=AlO2-+2H2O,根据图象可知生成溶解氢氧化铝消耗了0.2mL氢氧化钠,则生成氢氧化铝沉淀消耗了0.6mL氢氧化钠,故生成氢氧化镁沉淀消耗了0.1mL氢氧化钠,据此计算出镁离子与铝离子的物质的量之比,再结合二者化学式计算出氯离子和硫酸根离子的物质的量之比.
解答 解:根据离子方程式Al3++3OH-=Al(OH)3、Mg2++2OH-=Mg(OH)2、Al(OH)3+OH-=AlO2-+2H2O并结合图象可知,溶解氢氧化铝消耗氢氧化钠的体积是0.2mL,则生成氢氧化铝消耗的氢氧化钠溶液体积为0.6mL,所以生成氢氧化镁消耗的氢氧化钠是0.1mL,铝离子和镁离子消耗氢氧化钠溶液的物质的量之比为:6:1,
则Al3+和Mg2+的物质的量之比为:(6×$\frac{1}{3}$):(1×$\frac{1}{2}$)=4:1,
结合化学式MgCl2、Al2(SO4)3可知,溶液中Cl-与SO42-的物质的量之比为:(1×2):(4×$\frac{3}{2}$)=1:3,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象中曲线变化的含义及发生反应原理为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
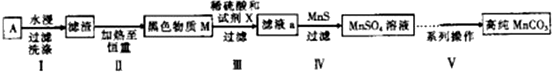
| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.3595 |
| 2 | 铁粉 | 2.7184 |
| 3 | 硫化亚铁 | 2.9911 |
| 4 | 30%过氧化氢 | 3.7349 |
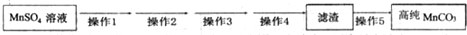
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. Al(OH)3+3H+(用离子方程式表示).
Al(OH)3+3H+(用离子方程式表示).| X | ||||
| Y | Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 二甲苯一溴代物的熔点/℃ | 234 | 206 | 213 | 204 | 214 | 205 |
| 对应的二甲苯的熔点/℃ | 13 | -54 | -27 | -54 | -27 | -54 |
| A. | 熔点为234℃的是一溴代间二甲苯 | B. | 熔点为234℃的是一溴代邻二甲苯 | ||
| C. | 熔点为-54℃的是间二甲苯 | D. | 熔点为-27℃的是对二甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
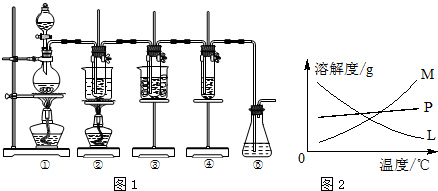
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com