
【题目】标准状况下,44.8 L H2的物质的量为
A. 1.0 mol B. 2.0 mol C. 3.0 mol D. 4.0 mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A. 半导体材料砷化镓 B. 吸氢材料镧镍合金
C. 透明陶瓷材料硒化锌 D. 超导材料K3C60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g)![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)1mol铁粉和1molCO2在2L密闭容器中反应,判断该反应达到平衡状态的依据是 (填序号)。
A.容器内压强不再改变
B.c(CO)不再改变
C.生成1mol的FeO
D.c(CO2)=c(CO)
E.v正(CO2)=v逆(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.4 mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K= (保留二位有效数字)。
(4)一定条件下,该反应在体积固定的密闭容器中进行一段时间后达到平衡状态。使该平衡状态正向移动的措施有(写出两条) 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上可在碱性溶液中通过电解的方法实现由N2制取NH3:
2N2+6H2O![]() 4NH3+3O2通入N2的一极是______(填“阴极”或“阳极”)阳极的电极反应式是_________________。
4NH3+3O2通入N2的一极是______(填“阴极”或“阳极”)阳极的电极反应式是_________________。
(2)有人设想寻求合适的催化剂和电极材料.以N2,H2为电极反应物;以HCl-NH4Cl为电解质榕液制取新型燃料电池。请写出该电池的正极反应式________________。
(3)电解原理在化学工业中有着广泛的应用。若用惰性电极电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体672mL(标准状况下)时,溶液的c(H+)=_____(假设电解后溶液体积不变)。
(4)铁、铝是现代金属材料的主角。
已知铝的燃烧热为1675kJ/mol,2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-822kJ/mol;
则2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △H=________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如右图:则下列判断正确的是( )
![]()
A. SO2发生了置换反应 B. SO2是该反应催化剂
C. x>y D. MFe2Ox是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氯气消毒的自来水配制下列溶液时,会使配制的溶液变质的是( )
①NaOH ②AgNO3 ③Na2CO3 ④ FeCl2
A.只有②④ B.只有④ C.只有② D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使明矾[ KAl(SO4)2·12H2O ]溶液中的 Al3+ 完全沉淀,应加入过量的
A.氨水 B.稀硫酸 C.氢氧化钠溶液 D.氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
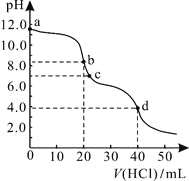
A. a点溶液呈碱性的原因用离子方程式表示为:CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. c点处的溶液中c(Na+)-c(Cl-)=c(HCO![]() )+2c(CO
)+2c(CO![]() )
)
C. 滴定过程中使用甲基橙作为指示剂比酚酞更准确
D. d点处溶液中水电离出的c(H+)大于b点处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com