
分析 Cu电极为阴极,发生反应:Cu2++2e-=Cu,阴极质量增重7.04g为析出Cu的质量,粗铜为阳极,由金属性Zn>Cu,故开始发生反应:Zn-2e-=Zn2+,Zn放电完全后,再发生反应:Cu-2e-=Cu2+,溶液质量增重为反应Zn+Cu2+=Cu+Zn2+所致,利用差量法计算Zn的质量,Zn放电时生成Cu的质量,由于Cu放电时,阳极溶解的Cu与阴极析出的Cu相等,故粗铜中Cu的质量=7.04g-Zn放电时生成Cu的质量.
解答 解:Cu电极为阴极,发生反应:Cu2++2e-=Cu,阴极质量增重7.04g为析出Cu的质量,粗铜为阳极,由金属性Zn>Cu,故开始发生反应:Zn-2e-=Zn2+,Zn放电完全后,再发生反应:Cu-2e-=Cu2+,溶液质量增重为反应Zn+Cu2+=Cu+Zn2+所致,
设Zn的质量为m,Zn放电生成Cu为n,则:
Zn+Cu2+=Cu+Zn2+ 溶液质量增重
65 64 65-64=1
m n 0.02g
所以m=$\frac{0.02g×65}{1}$=1.3g
n=$\frac{0.02g×64}{1}$=1.28g
粗铜总质量为(7.04g-1.28g)+1.3g=7.06g
故粗铜中Zn的质量分数为$\frac{1.3g}{7.06g}$×100%=18.4%,
答:粗铜中含锌的质量分数为18.4%.
点评 本题考查电解原理及有关计算,关键是根据离子放电顺序理解溶液增重原因、阴极质量增重不等于粗铜中Cu的质量,属于易错题目,学生容易认为阴极增重质量为粗铜中含有Cu的质量,侧重于学生的分析能力和计算能力的考查,难度中等.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列对0.3mol/L K2SO4溶液的正确说法是
A.1L溶液中含有0.4NA个钾离子
B.1L溶液中含有K+离子和SO42-离子总数为0.9NA
C.2L溶液中钾离子的浓度为1.2mol/L
D.2L溶液中含有0.3NA个SO42-离子
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
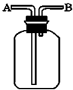 现有六种气体:H2、O2、NH3、SO2、NO2、NO.可以利用如图所示装置进行收集.
现有六种气体:H2、O2、NH3、SO2、NO2、NO.可以利用如图所示装置进行收集.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
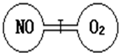 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.已知2NO+O2═2NO2,打开活塞,使NO与O2充分反应,则下列说法错误的是( )
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.已知2NO+O2═2NO2,打开活塞,使NO与O2充分反应,则下列说法错误的是( )| A. | 开始时左右两室分子数相同 | B. | 反应开始后NO室压强减小 | ||
| C. | 最终容器内密度与原来相同 | D. | 最终容器内仍然有O2存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
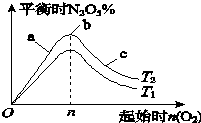 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2SO4 | B. | H2SO4 | C. | Ba(OH)2 | D. | AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com