
分析 根据Ksp[Al(OH)3]=c(Al3+)•c3(OH-)可计算出氢氧根离子的浓度,进而确定溶液的pH值.
解答 解:根据Ksp[Al(OH)3]=c(Al3+)•c3(OH-)可知,c(OH-)=$\root{3}{\frac{8.0×1{0}^{-33}}{1.0×1{0}^{-6}}}$=2×10-9,所以c(H+)=$\frac{{K}_{W}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{2×1{0}^{-9}}$=5×10-6,pH值为6-lg5=5.3,
故答案为:5.3.
点评 本题考查难溶电解质溶解平衡的计算,同时考查了水的离子积常数以及PH值的计算,综合性强,难度中等.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
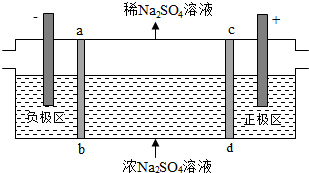
| A. | 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大 | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 负极反应为2H2O-4e-=O2+4H+,负极区溶液pH降低 | |
| D. | 当电路中通过1mol电子的电量时,会有0.5mol的O2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、OH-、NO3- | B. | Ba2+、H+、SO42- | C. | K+、OH-、CO32- | D. | Fe3+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
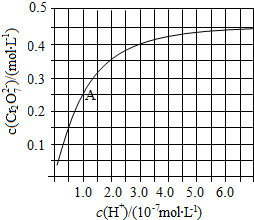 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 《神农本草经》记载,麻黄能“止咳逆上气” | 碳酸氢钠药片 |  |  |
| 古代中国人已用麻黄治疗咳嗽 | 该药是抗酸药,服用时喝些醋能提高药效 | 看到有该标志的丢弃物,应远离并报警 | 贴有该标志的物品是可回收物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
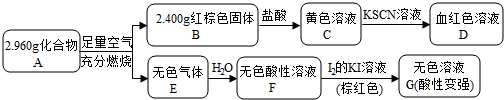
 ,写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑;
,写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,则反应释放能量 | |
| B. | 物质燃烧可看做“储存”在物质内部的能量(化学能)转化为热能释放出来 | |
| C. | 钠原子与氯原子结合生成氯化钠后,其结构的稳定性增强,体系的能量降低 | |
| D. | 当断开旧键吸收的能量大于形成新键放出的能量时,该反应为吸收能量的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com