
【题目】下列反应的离子方程式正确的是( )
A. 碳酸钙跟醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫酸铝溶液中加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH![]()
C. 向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D. 碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO![]() =BaCO3↓+CO
=BaCO3↓+CO![]() +2H2O
+2H2O
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中位置关系如图所示。
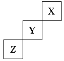
(1)X元素的单质分子式是___。若X核内中子数与质子数相等,X单质的摩尔质量是___。
(2)Y单质的电子式是___。
Y单质与水反应的化学方程式:___。
Z与钠形成的化合物的电子式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在我们的生产生活中占有越来越重要的地位。
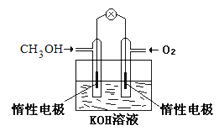
(1)①燃料电池是一种绿色环保、高效的化学电源。上图为甲醇燃料电池,则负极反应式为____。
②用甲醇燃料电池电解300mL饱和食盐水,则电解的化学方程式为_________。电解一段时间后,当溶液的pH值为13时,消耗O2的质量为______g。(忽略溶液体积变化,不考虑损耗)
③用甲醇燃料电池电解2L,1mol/L硫酸铜溶液,一段时间后:两极共收集到标准状况下的气体89.6L,则电路中共转移_______mol电子。
(2)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
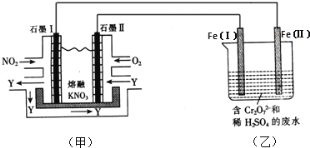
①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为__。
②向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5molL-1,溶液的pH应调至________。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5molL-1,溶液的pH应调至________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物具有不同程度的毒性,利用构成电池方法既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,发生反应 6NO2+ 8NH3= 7N2+12H2O,装置如图所示。下列关于该电池的说法正确的是

A. 为使电池持续放电,离子交换膜需选用阴离子交换膜
B. 电子从右侧电极经过负载后流向左侧电极
C. 电极A极反应式为2NH3 - 6e-=N2 +6H+
D. 当有4.48LNO2被处理时,转移电子物质的量为 0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)![]() C3H6(g)+H2(g),△H=_________kJ/.mol
C3H6(g)+H2(g),△H=_________kJ/.mol

(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________。

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0
2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X形成的气态X2的分子共有三种,其相对分子质量依次为158、160、162,此三种分子的物质的量之比为9:6:1,据此,下列说法中正确的是( )
A.X有三种同位素
B.其中一种同位素的质量数为80
C.X2的平均相对分子质量为159
D.质量数为79的同位素的原子百分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸时,其中之一的反应是2SO2+O2![]() 2SO3,下列说法错误的是
2SO3,下列说法错误的是
A. 使用催化剂能显著增大反应速率
B. 压缩体积可提高反应速率
C. 达到化学平衡时,反应停止
D. 增大SO2的浓度可提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与1.12 L O2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5 mol·L-1 H2SO4溶液100 mL,则继续溶解的Cu的质量为( )
A. 6.4 g B. 9.6 g C. 19.2 g D. 24 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g) + I2(g) ![]() 2HI(g) △H < 0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入0.1mol H2和0.2mol I2,相同温度下分别达到平衡。下列说法不正确的是( )
2HI(g) △H < 0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入0.1mol H2和0.2mol I2,相同温度下分别达到平衡。下列说法不正确的是( )
A. 乙中反应速率比甲中反应速率快
B. 平衡时甲、乙两容器中混合物的总物质的量之比为2:3
C. 若平衡时甲中H2的转化率为40%,则乙中H2的转化率大于40%
D. 平衡后,向乙中再加入0.1mol H2,建立新的平衡时,甲和乙中H2的百分含量不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com