
下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子为非极性分子 |
| C | 金刚石的熔点低于石墨 | 石墨熔融时除了破坏共价键,还需破坏范德华力 |
| D | HF的沸点高于HCl | H﹣F的键能大于H﹣Cl |
|
| A. | A | B. | B | C. | C | D. | D |
考点:
键能、键长、键角及其应用;元素电离能、电负性的含义及应用;晶体的类型与物质熔点、硬度、导电性等的关系;极性分子和非极性分子.
专题:
化学键与晶体结构.
分析:
A、氮原子2p能级半充满,所以比较稳定,难以失去电子;
B、CO2分子是直线型;
C、金刚石是原子晶体;
D、从HF分子中含有氢键角度分析.
解答:
解:A.氮原子2p能级半充满,所以比较稳定,氮原子的第一电离能大于氧原子,故A正确;
B.理论解释不对,CO2分子的价层电子对是2,根据价层电子对互斥理论,CO2分子是直线型,故B错误;
C.金刚石是原子晶体,故C错误;
D.理论解释不对,HF分子中含有氢键,故HF的沸点高于HCl,故D错误.
故选A.
点评:
本题考查物质结构与性质知识,难度不大,注意CO2分子的价层电子对是2,根据价层电子对互斥理论,CO2分子是直线型.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L酒精含有的分子数为 NA
B.常温常压下,1.06g Na2CO3含有的Na+ 离子数为0.01 NA
C.11.2 L H2所含的电子数为NA
D.通常状况下,NA 个C O2分子含有原子数为3 NA
O2分子含有原子数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2 LO2和O3组成的混合气体含有原子数为NA
B.常温常压下,1.7 g NH3含有的电子数目为 NA
C.0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA
D.常温常压下,22.4 LCO2与足量Na2O2反应转移电子数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的下列性质不能用键能来解释的是( )
|
| A. | 氮气的化学性质没有氯气活泼 |
|
| B. | HF比HCl稳定 |
|
| C. | 金刚石的熔点比晶体硅高 |
|
| D. | 常温下溴呈液态,碘呈固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
拆开1mol化学键所吸收的能量是该化学键的键能,它的大小可以衡量化学键的强弱.
| 化学键 | Si﹣O | Si﹣Cl | H﹣H | H﹣Cl | Si﹣Si | Si﹣C |
| 键能/kJ•mol﹣1 | 460 | 360 | 436 | 431 | 176 | 347 |
下列说法中错误的是( )
|
| A. | SiCl4的熔点比SiC低 |
|
| B. | 拆开1 mol晶体硅中的化学键所吸收的能量为176kJ |
|
| C. | HCl的熔点比H2高 |
|
| D. | 拆开1 mol晶体SiC中的化学键所吸收的能量为1388kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
以下四种物质,其中A、B各代表一种离子晶体的晶胞,C代表一种合金的晶胞,D则代表一个由A、B原子组成的团簇分子,其中化学式错误的是( )
|
| A. |
AB | B. |
XY3Z | C. |
EF | D. |
AB |
查看答案和解析>>
科目:高中化学 来源: 题型:
西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害.已知其相关性质如下表所示:
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O |
| 白色结晶粉末 | 170~172°C | 易溶于水 |
(1)氯元素基态原子核外电子的成对电子数为 .
(2)氯吡苯脲的晶体类型为 ,所含第二周期元素第一电离能从大到小的顺序为 N .
(3)氯吡苯脲晶体中,氮原子的杂化轨道类型为 .
(4)氯吡苯脲晶体中,微粒间的作用力类型有 .
A.离子键 B.金属键 C.共价键 D.配位键 E.氢键
(5)氯吡苯脲熔点低,易溶于水的原因分别为
(6)查文献可知,可用2﹣氯﹣4﹣氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲.
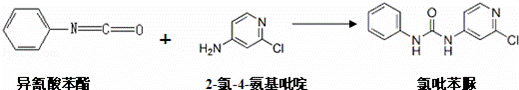
反应过程中,每生成1mol氯吡苯脲,断裂 个σ键、断裂 个π键.
查看答案和解析>>
科目:高中化学 来源: 题型:
某浓度的铬酸溶液(H2CrO4),向其中加入少量碱以调节pH值(忽略溶液体积变化),下表为各离子浓度(mol/L)与pH之间的关系如下表,下列说法不正确的是( )
| pH | [H2CrO4] | [HCrO4﹣] | [CrO42﹣] | [Cr2O72﹣] |
| 4 | 0 | 0.095 | 0.035 | 0.435 |
| 7 | 0 | 0.086 | 0.274 | 0.320 |
| 10 | 0 | 0.004 | 0.990 | 0.003 |
|
| A. | 铬酸的电离方程式为H2CrO4═2H++CrO42﹣ |
|
| B. | 铬酸的总浓度为1mol/L |
|
| C. | [H+]越大,HCrO4﹣浓度越大 |
|
| D. | 已知Cr2O72﹣为橙色离子,CrO42﹣为黄色离子,随着pH的升高溶液将逐渐变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于营养物质的说法正确的是( )
|
| A. | 油脂的氢化属于还原反应,又属于加成反应,生成物为纯净物 |
|
| B. | 氨基酸和蛋白质分子中都含有氨基和羧基,二者均有两性 |
|
| C. | 淀粉溶液和稀硫酸共热后发生水解反应,冷却后加少量银氨溶液,水浴加热后会出现光亮的银镜 |
|
| D. | 鸡蛋白溶液中加入浓硝酸溶液,出现白色沉淀,加热,沉淀变黄色,该过程叫作蛋白质的变性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com