
【题目】功能高分子P的合成路线如下:

(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
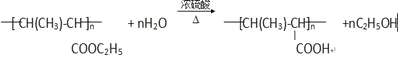
(6)反应⑤的化学方程式:_______________。
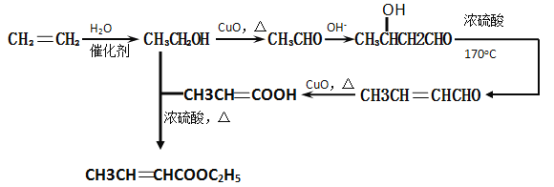
(5)已知:2CH3CHO 。
。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。
【答案】(1)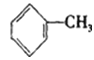
(2)浓硫酸和浓硝酸
(3)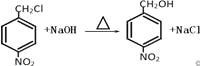
(4)碳碳双键、酯基
(5)加聚反应
(6)
(7)
【解析】
试题根据高分子P的结构和A的分子式为C7H8,可以推出,D为对硝基苯甲醇,那么A应该为甲苯,B为对硝基甲苯,C为一氯甲基对硝基苯,(1)A的结构式为 ,答案为:
,答案为: ;(2)甲苯和硝酸在浓硫酸催化作用下生成对硝基苯,所以试剂a为浓硫酸和浓硝酸,答案为:浓硫酸和浓硝酸;
;(2)甲苯和硝酸在浓硫酸催化作用下生成对硝基苯,所以试剂a为浓硫酸和浓硝酸,答案为:浓硫酸和浓硝酸;
(3)反应③是一氯甲基对硝基苯在氢氧化钠的水溶液中发生取代反应生成对硝基苯甲醇,反应的化学方程式为: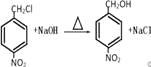 ,答案为:
,答案为: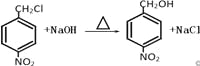 ;
;
(4)根据高分子P的结构式,再结合E的分子式可以推出E的结构式为CH3CH=CHCOOC2H5,所含官能团有碳碳双键、酯基,答案为:碳碳双键、酯基;(5)F应该是E发生加聚反应生成的一个高分子化合物,所以反应④是加聚反应,答案为:加聚反应;(6)反应⑤的化学方程式为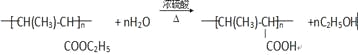 ,
,
答案为: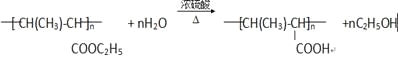 ;
;
(7)乙烯和水可以直接加成生成乙醇,乙醇氧化生成乙醛,乙醛发生已知条件中的反应既可以使碳链增长,在氧化醛基为羧基,3-羟基丁酸消去即可得2-丁烯酸,羧酸和乙醇发生酯化反应,即可得物质E,合成路线为:


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下 :(废料中的其他金属含量较低,对实验影响可忽略)

已知:① AgCl可溶于氨水,生成[Ag(NH3)2]+;
② Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取____________措施(写出其中一种即可)。
(2)操作IV经过_______________、_________________、过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是________________________________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为_________________________________(其中AgCl和NaCl的物质的量之比为2:1)。氧化的同时发生沉淀转化,离子方程式为______________________________,其平衡常数K=_____________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气在氯气中燃烧生成氯化氢,同时产生苍白色火焰,下列说法正确的是( )
A. 该反应是放热反应B. 该反应是吸热反应
C. 断裂H-H键放出热量D. 形成H-Cl键吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓硫酸试剂瓶标签上的有关数据,根据标签上的数据回答下列问题:

(1)取任意体积的该浓硫酸时,下列物理量会随所取体积的多少而发生变化的是________(选填相应字母编号)
A.溶液密度 B.溶液的物质的量浓度
C.溶液的质量分数 D.溶质的物质的量
(2)某学生欲用上述浓硫酸和蒸馏水配制450mL物质的量浓度为1.0mol·L-1的稀硫酸。
①该学生需要用量筒量取________mL上述浓硫酸进行配制。
②该实验中除了量筒、玻璃棒和烧杯外,还缺少的玻璃仪器有_________。
③在配制过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?(在后面横线选择填写相应字母标号A、偏高;B、偏低;C、无影响)
I、用量筒量取浓硫酸时仰视凹液面读数_________
II、转移时容量瓶中已经有少量蒸馏水________
Ⅲ、定容时仰视刻度线__________
Ⅳ、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如右图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。

pH =4.5(其他条件相同)
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化氢极易溶于水,标准状况下,1体积的水可以溶解500体积的氯化氢(HCl)气体,氯化氢的水溶液即为盐酸。
实验室现有质量分数为36.5%、密度为1.19gcm﹣3的浓盐酸,若用该浓盐酸配制0.4molL﹣1的稀盐酸220mL,试回答下列问题:
(1)配制该稀盐酸时,应选用的容量瓶的容积为(______).
A. 100mL B. 220mL C. 250mL D. 500mL
(2)计算需要____mL的浓盐酸,
(3)在量取浓盐酸后,进行了下列操作:
①待稀释盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中.
②往容量瓶中加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.
③在盛蒸馏水的烧杯中注入盐酸,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)_____________。
(4)在下述配制过程中,配制的稀盐酸浓度将会偏高的是_________________;使浓度会偏低的是 _________________________。(填序号)
①未转移溶液前容量瓶中有少量的蒸馏水
②量取浓盐酸时俯视刻度线
③量取浓盐酸后用蒸馏水洗涤量筒
④若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
⑤定容时俯视刻度线
(5)在标准状况下,用一支收集满HCl气体的试管倒立在水槽中,水倒吸当充满试管时用塞子堵住试管口竖立(假设溶液不泄漏),则该溶液的溶质的物质的量浓度为_________________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.84 g/cm3、溶质的质量分数为98 %的硫酸,配制250 mL物质的量浓度为0.46 mol/L的硫酸。
(1)98 %的浓硫酸的物质的量浓度为_________。
(2)现有下列几种规格的量筒,应选用______(填序号)。
①5 mL量筒 ②10 mL量筒 ③50 mL量筒 ④100 mL量筒
(3)实验需要以下步骤:
①定容②量取③摇匀④洗涤⑤转移⑥冷却⑦计算⑧装瓶⑨稀释进行顺序为_______。
(4)下列操作使所配溶液的物质的量浓度偏高的是__________。
A.往容量瓶中转移溶液时有少量液体溅出
B.未洗涤稀释浓H2SO4的小烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铁胶体的制备与其性质检验实验如下,请回答下列问题。
(1)写出制备氢氧化铁胶体的化学方程式_____。
(2)制备实验操作:取一小烧杯加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2mL____,继续煮沸至___,停止加热。
(3)证明有氢氧化铁胶体生成的实验操作是______。
(4)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是___,这种现象称为胶体的____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,反应速率与时间的关系图中,纵坐标为反应速率v,横坐标为时间t,当反应达到平衡后,条件发生改变与速率变化的关系中不符合实际的是( )
2NH3(g) ΔH<0,反应速率与时间的关系图中,纵坐标为反应速率v,横坐标为时间t,当反应达到平衡后,条件发生改变与速率变化的关系中不符合实际的是( )
A. 恒容恒压升高温度 B. 恒温、恒压压缩体积
B. 恒温、恒压压缩体积 C. 加入催化剂
C. 加入催化剂 D. 补充氮气和氢气分离氨气
D. 补充氮气和氢气分离氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com