
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体
稀硝酸的溶液中,恰好完全反应,放出无色气体![]() 标准状况下
标准状况下![]() 。将反应后的溶液分成2等份,向一份溶液中滴加
。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体![]() ,减轻了
,减轻了![]() ,再加入到过量的
,再加入到过量的![]() 溶液中,剩余不溶物
溶液中,剩余不溶物![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()
已知:![]() 遇到
遇到![]() 会出现蓝色沉淀;
会出现蓝色沉淀; ![]()
A.![]()
B.原合金中铜的质量为![]()
C.若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() 标准状况下
标准状况下![]()
D.d不是一确定值,可能为8
【答案】D
【解析】
A.将反应后的溶液分成2等份,一份溶液中滴加![]() 溶液,无明显现象,则不含
溶液,无明显现象,则不含![]() ,所以溶液为
,所以溶液为![]() 、
、![]() 、
、![]() 的混合液。在另一份溶液中滴加氨水至过量,得到沉淀
的混合液。在另一份溶液中滴加氨水至过量,得到沉淀![]() 为
为![]() 和
和![]() ,
,![]() 则转变为
则转变为![]() ,过滤后进入滤液。固体
,过滤后进入滤液。固体![]() 为
为![]() 和
和![]() ,不溶物
,不溶物![]() 为
为![]() ,合金加入到硝酸溶液后,放出无色气体
,合金加入到硝酸溶液后,放出无色气体![]() 标准状况下
标准状况下![]() 即
即![]() ,根据得失电子守恒,合金总共失去电子
,根据得失电子守恒,合金总共失去电子![]() ,反应后溶液中阳离子带正电荷
,反应后溶液中阳离子带正电荷![]() ,所以溶液中硝酸根
,所以溶液中硝酸根![]() ,所以
,所以![]() ,A正确;
,A正确;
B.根据电子守恒可知:![]() ,合金总质量为:
,合金总质量为:![]() ,固体减少的
,固体减少的![]() 为氢氧化铝、氢氧化铁分解生成的水,则
为氢氧化铝、氢氧化铁分解生成的水,则![]() ,固体
,固体![]() 和
和![]() 中H元素的物质的量之和等于:
中H元素的物质的量之和等于:![]() ,可得
,可得![]() ,原固体中
,原固体中![]() ,
,![]() ,则
,则![]() ,所以
,所以![]() ,B正确;
,B正确;
C.由于溶液中不含![]() ,为
,为![]() 、
、![]() 、
、![]() 的混合液,所以硝酸足量,若将上述nmol稀硝酸逐滴加入到合金中,先生成
的混合液,所以硝酸足量,若将上述nmol稀硝酸逐滴加入到合金中,先生成![]() ,后
,后![]() 继续被硝酸氧化,由于硝酸足量,最终生成
继续被硝酸氧化,由于硝酸足量,最终生成![]() 、
、![]() 、
、![]() ,根据得失电子守恒生成的NO气体仍为
,根据得失电子守恒生成的NO气体仍为![]() ,C正确;
,C正确;
D.最后剩余不溶物dg,为![]() ,是一确定值,D错误。
,是一确定值,D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4
-环己二酮单乙二醇缩酮)为原料合成(如下图)。
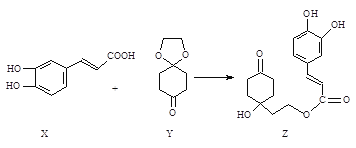
试填空:
(1)X的分子式为_______;该分子中最多共面的碳原子数为________。
(2)Y中是否含有手性碳原子_____(填“是”或“否”)。
(3)Z能发生_______反应。(填序号)
A.取代反应 B.消去反应 C.加成反应
(4)1 mol Z与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠________mol;
1 mol Z在一定条件下与足量H2充分反应,需要消耗H2 ________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一个电解装置,该装置中X、Y分别为石墨电极,现分别在U型管中加入下列溶液进行电解,请回答有关问题:
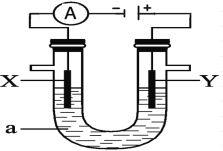
(1)若U型管中的液体a为饱和食盐水:在电极Y上产生的气体是_________ (填分子式),检验有该气体生成的简单方法是________________________;若该饱和食盐水中还含有少量的镁离子,则有可能在______极(选填“X”或“Y”)附近会首先生成白色不溶物;当电解产生0.2mol氢氧化钠时,能收集到标准状况下的氢气 ______升;工厂应用电解生成的氯气和氢气可以化合生成氯化氢,某工厂每天电解400t食盐,若生成的氯气80%用于生产盐酸,每天最多可生产31%的盐酸__________ t。(保留至整数)
(2)若U型管中的液体a为饱和氯化铜溶液:电极质量增加的是_______选填“X”或“Y”)极,该电极上发生______反应(选填“氧化”或“还原”);若要得到0.32克铜,理论上在电解过程中应转移_________mol电子;氯化铜溶液显酸性,原因是(用离子方程式表示)_______________________________;电解一段时间后,请你推测:整个溶液的酸性将如何变化(增强、减弱、不变,同时请写出理由:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.mA(g)+nB(g) ![]() pC(g),平衡时A的浓度等于0.5mol·L-1 ,其它条件不变,将容器体积扩大一倍,达到新的平衡时A的浓度变为0.3mol·L-1 ,则化学计量数m+n<p
pC(g),平衡时A的浓度等于0.5mol·L-1 ,其它条件不变,将容器体积扩大一倍,达到新的平衡时A的浓度变为0.3mol·L-1 ,则化学计量数m+n<p
B.将一定量纯净的氨基甲酸铵置于密闭真空容器中,在恒定温度下使其分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判定依据
2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判定依据
C.对于反应A(g)+B(g) ![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时给体系加压,则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时给体系加压,则A的体积分数不变
D.2NO(g)+2CO(g) ![]() N2+2CO2在常温下能够进行,则反应的△H <0
N2+2CO2在常温下能够进行,则反应的△H <0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与50 mL 0.1 mol·L-1的Na2CO3溶液中Na+的物质的量相同的溶液是( )
A.50 mL 0.2 mol·L-1的NaCl溶液B.100 mL 0.2 mol·L-1的NaCl溶液
C.25 mL 0.1 mol·L-1的Na2SO4溶液D.50 mL 0.1 mol·L-1的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是____________________,该现象说明二氧化硫具有的性质是________________________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气可采用__________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了为锂电池发展作出突出贡献的三位科学家。某废旧锂电池正极主要由LiFePO4、铝箔、炭黑等组成,Fe、Li、P具有极高的回收价值,具体流程如下:

(1)过程ⅰ生成NaAlO2溶液的离子方程式是__。
(2)过程ⅱ中HCl/H2O2的作用是__。
(3)浸出液X的主要成分为 Li+、Fe3+、H2PO4-等。过程ⅲ控制碳酸钠溶液浓度20%、温度85 ℃、反应时间3 h条件下,探究pH对磷酸铁沉淀的影响,如图所示。
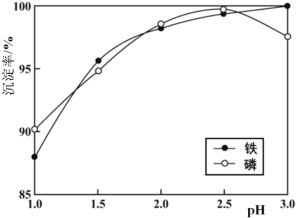
①综合考虑铁和磷沉淀率,最佳pH为__。
②结合平衡移动原理,解释过程ⅲ中pH增大,铁和磷沉淀率增大的原因__。
③当pH>2.5后,随pH增加,磷沉淀率出现了减小的趋势,解释其原因__。
(4)LiFePO4可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应制取,共沉淀反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中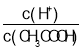 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaSO4在医疗上可作钡餐,高温煅烧BaSO4部分反应如下:
BaSO4(s)+4C(s) BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)BaSO4(s) ΔH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com