
| 催化剂 |
| △ |
| 变化量 |
| 起始量 |
| (1-0.8)mol/L |
| 2min |
| 0.2mol/L×2L×2 |
| 2mol |
| 2-4x+2-2x+ 4x |
| 2+2 |
| 0.4mol×2 |
| 2mol |


科目:高中化学 来源: 题型:
| A、滴加甲基橙试液显红色的溶液:Fe2+、NH4+、SCN-、ClO- |
| B、含有大量SO42-的溶液:NH4+、Mg2+、Cl-、NO3- |
| C、水电离出的c(H+)=1×10-12 mol/L的溶液:S2O32-、C2O42-、K+、Na+ |
| D、能与Al反应放出H2的溶液:K+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为1L),则下列判断正确的是( )
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为1L),则下列判断正确的是( )| A、图中线段oa:ab=3:1 |
| B、NaOH溶液物质的量浓度为0.6 mol?L-1 |
| C、在b点处溶液中的溶质只有Na[Al(OH)4] |
| D、混合溶液中Al3+与Mg2+物质的量比值为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| n(Ca) |
| n(P) |
| n(Ca) |
| n(P) |

| n(Ca) |
| n(P) |
| PH值 | 6.8 | 7.2 | 8.0 | 9.0 | 10.0 | ||
| 产率(%) | 92.6 | 95.3 | 96.7 | 94.6 | 95.6 | ||
|
1.51 | 1.50 | 1.51 | 1.52 | 1.52 |
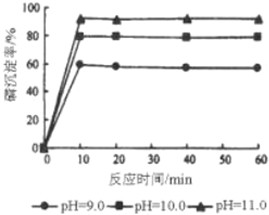
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
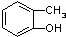 和
和 ⑥
⑥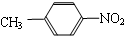 和
和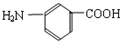
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com