
【题目】

(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中Cl-的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响? (填“偏大”“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面: 。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水: 。
(4)硅单质是一种重要的非金属单质,其用途是 (举一例)
(5)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。

(6)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
【答案】(1)11.9 mol·L-1。
(2)BD
(3)①16.8mL ;②a.偏小;b.偏小
(4)半导体、电子芯片、光电池
(5)B
(6)2.4 mol/L≥c≥1.2 mol/L
【解析】试题分析:(1)质量分数36.5%、密度1.19g/mL 浓盐酸的物质的量浓度=![]() =11.9mol/L。故答案为:11.9;
=11.9mol/L。故答案为:11.9;
(2)溶液是均匀的,溶液的密度、浓度不随体积变化,而HCl的物质的量及Cl-的数目与溶液体积有关。故答案为:BD;
(3)①令需要浓盐酸的体积为V mL,根据稀释定律,稀释前后HCl的物质的量不变,则:
V×10-3L×11.9mol/L="0.5" L×0.400mol/L,解得:V=16.8。
故答案为:16.8;
②在配制过程中,Ⅰ.a.用量筒量取浓盐酸时俯视观察凹液面,造成量取浓盐酸的体积偏小,导致最终所配溶液浓度偏低;b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液体积偏大,所配溶液浓度偏小。
故答案为:偏小;偏小;
(4)硅单质是一种重要的非金属单质,其用途主要有:半导体材料、电子芯片、光电池(举一例)。
故答案为:半导体、电子芯片、光电池;
(5)由于高温条件下SiO2和NaOH焙烧制备硅酸钠,所以完成该实验时可采用的装置为B(填代号)。
故答案为:B;
(6)某H2中含有2.40molCO2,该混合气体通入2.00LNaOH溶液中,CO2被完全吸收。设NaOH的物质的量为xmol,如果NaOH完全反应生成Na2CO3,则x=2n(CO2)=2.40mol×2=4.80mol,c(NaOH)=4.80mol/2.00L=2.4mol/L;
如果NaOH完全反应生成NaHCO3,则x=n(CO2)=2.40mol,(NaOH)=2.40mol/2.00L=1.2mol/L;
该NaOH溶液的浓度为:2.4mol/L≥c≥1.2mol/L。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】原子序数为x的元素R。在周期表中位于A,B,C,D 4种元素的中间。A,B,C,D 4种元素的原子序数之和不可能为
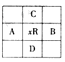
A. 4x B. 4x+10 C. 4x+5 D. 4x+14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年中国已超北美成为全球液晶显示器第二大市场。生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:

下列说法中不正确的是 ( )
A.过程F2(g)→2F(g)吸收能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)=2NF3(g)的ΔH<0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”。因此,不少汽车都安装尾气净化装置(净化处理过程如图)。下列有关叙述,错误的是( )

A.尾气造成“雾霾”与汽油未充分燃烧有关
B.尾气处理过程,氮氧化物(NOX)被还原
C.Pt-Rh催化剂可提高尾气净化反应的平衡转化率
D.使用氢氧燃料电池作汽车动力能有效控制雾霾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将28.8g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)将产生的气体全全释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为 mol·L-1。
(3)若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟七号”所用动力燃料之一为氢化锂“三兄弟”——LiH、LiD、LiT。有关LiH、LiD、LiT叙述正确的是( )
A. 质子数之比为1∶2∶3
B. 中子数之比为1∶1∶1
C. 摩尔质量之比为8∶9∶10
D. 化学性质不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同。请回答下列问题:

(1)A在元素周期表中的位置 。
B的最高价氧化物化学式为 。
写出C元素气态氢化物的电子式 。
(2)D的单质与水反应的化学方程式为_ 。
(3)五种元素中原子半径最小的是______(填元素符号),这些元素的最高价氧化物的对应水化物中________酸性最强。
(4)C的一种氧化物是常见的大气污染物。为防止大气污染,某化工厂用NaOH溶液、石灰和O2处理含C的上述氧化物的尾气,使其转化为石膏(CaSO4·2H2O)。假设在转化过程中C元素不损失,每天处理1120 m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上可以得到多少千克石膏(请写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足下图所示转化关系的是( )

甲 | 乙 | 丙 | 戊 | |
A | NH3 | Cl2 | N2 | H2 |
B | C | SiO2 | CO | CuO |
C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com