
【题目】下列叙述正确的是
A. 使用催化剂能够降低化学反应的反应热(△H)
B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO
C. 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
D. 电镀时,待镀的金属制品表面发生还原反应
科目:高中化学 来源: 题型:
【题目】下列关于反应速率和反应平衡的说法中,错误的是
A.反应速率用于衡量化学反应的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡时,正、逆反应速率都为0
D.增大反应物浓度,提高反应物的温度都能增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅧA | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题.
(1)元素④的名称是 ,从元素原子得失电子的角度看,元素④具有 性(填“氧化性”、“还原性”);
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性: (写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是 (用离子符号表示)
(4)元素⑦的原子结构示意图是 ;
(5)最高价氧化物对应水化物酸性最强的酸是 ,化学性质最稳定的是 金属性最强的元素是 (用化学符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中一定能大量共存的是( )
A.使pH试纸呈蓝色的溶液中:I-、Cl-、NO3-、Cu2+
B.使酚酞呈深红色的溶液中:Na+、Cl- 、H+、NO3-
C.含大量Ag+ 的溶液中:K+、Na+、NO3-、SO42-
D.含大量OH- 的溶液中:CO32-、Cl-、F- 、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,X、Y分别是直流电源的两极,通电后发生a极板质量增加,b极板处有无色无臭气体放出。符合这一情况的是( )
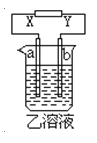
a极板 | b极板 | X电极 | 乙溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2kJmol-1则Q1、Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素符号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是( )
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.一定条件下,W单质可以将Z单质从其氢化物中置换出来
D.Y的最高价氧化物对应的水化物能溶于稀氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
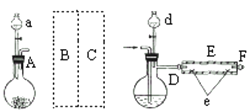
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:______________________________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述中正确的是
A.用活性炭为榶浆脱色和用双氧水漂白纸浆,其原理相同
B.铜制品在潮湿空气中生锈,其主要原因是发生析氢腐蚀
C.静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体
D.新型能源生物柴油和矿物油主要化学成分相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com