
【题目】天然气、可燃冰、页岩气、沼气的主要成分都是甲烷,甲烷既是一种清洁能源,也是一种重要的化工原料。
(1)以甲烷为主要原料可生产合成气(CO和H2)。
已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-802.3 kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH=-41.0 kJ·mol-1
③2CO(g)+O2(g)===2CO2(g)
ΔH=-566.0 kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=__________________。
2CO(g)+2H2(g)的ΔH=__________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CO2(g)+CH4(g) ![]() CH3COOH(g)。
CH3COOH(g)。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是_________________________。
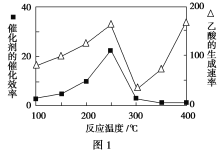
②为了提高该反应中CH4的转化率,可以采取的措施是______________________(写出一条即可)。
(3)甲烷燃料电池是一种新型电池。如图2所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ可实现铁棒上镀铜。
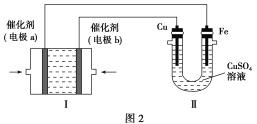
①电极b上的电极反应式是______________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8 g,则装置Ⅰ中理论上消耗的氧气在标准状况下的体积为________L。
【答案】(1)+247.7 kJ·mol-1
(2)①温度超过250 ℃时,催化剂的催化效率降低 ②缩小容器体积(增大压强)或增大CO2的浓度(答出一条即可)
(3)①O2+2H2O+4e-===4OH- ②变小 不变 ③2.24
【解析】(1)根据盖斯定律,将①+②×2-③×2得目标方程式,其ΔH=(-802.3-41.0×2+566.0×2) kJ·mol-1=+247.7 kJ·mol-1。
(2)①温度超过250 ℃时,催化剂的催化效率降低,导致反应速率降低。②CO2(g)+CH4(g) ![]() CH3COOH(g)是气体物质的量减少的反应,缩小容器体积(增大压强),平衡正向移动,CH4的转化率增大。增大CO2的浓度也可使平衡正向移动,提高CH4的转化率。
CH3COOH(g)是气体物质的量减少的反应,缩小容器体积(增大压强),平衡正向移动,CH4的转化率增大。增大CO2的浓度也可使平衡正向移动,提高CH4的转化率。
(3)①在铁棒上镀铜时,铜棒是阳极,铁棒是阴极,与铜棒相连的电极是电源的正极,与铁棒相连的电极是电源的负极,故a为负极,通入甲烷,b为正极,通入氧气,氧气在碱性条件下得电子生成OH-。②该甲烷燃料电池的总反应为CH4+2O2+2KOH===K2CO3+3H2O,故电镀结束后,装置Ⅰ中溶液的pH减小;电镀池中,阳极铜溶解,阴极析出铜,溶液中Cu2+的物质的量浓度不变。③装置Ⅱ中阴极增加的质量是Cu的质量,n(Cu)=0.2 mol,则反应中转移0.4 mol电子,根据电子得失守恒,可知理论上应消耗0.1 mol O2,在标准状况下的体积为2.24 L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
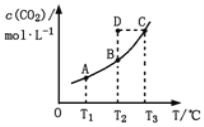
A. 反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的 ΔH>0
CO2(g)+H2(g)的 ΔH>0
B. 在T2时,若反应处于状态D,则一定有ν正<ν逆
C. 平衡状态A与C相比,平衡状态A的c(CO)小
D. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1
2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)的△H=______kJmol-1.
(2)一定条件下,将NO2与SO2以物质的量比为1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。[不考虑N2O4(g)![]() 2NO2(g)的转化]
2NO2(g)的转化]
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
(3)测得上述反应平衡时NO2与SO2物质的量比为1:6,则平衡时SO2的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,称为人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是
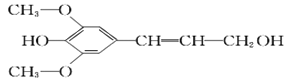
A. 芥子醇的分子式中有一种含氧官能团
B. 芥子醇分子中所有碳原子不可能在同一平面上
C. 芥子醇能与FeCl3溶液发生显色反应,且1mol芥子醇能够与3 mol的Br2水反应
D. 芥子醇能发生的反应类型有氧化、取代、加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质,正盐:钾盐、钠盐、铵盐、钡盐;酸:盐酸、硝酸、醋酸、稀硫酸.在水溶液中符合离子方程式:2H++CO32﹣= CO2↑+H2O的化学反应的组合共有( )
A.6个 B.9个 C.12个 D.15个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)===N2O4(g)
ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式: ___________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施):___________________________。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。
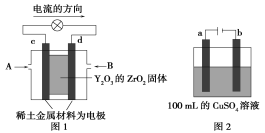
①c电极的名称为________,d电极上的电极反应式为_________________________。
②如图2所示为电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为____________________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填序号)。
a.CuO b.Cu(OH)2
c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是 ( )
A.NaHCO3 = Na++H++CO32- B.NaHSO4 = Na++H++SO42-
C.Mg(NO3)2 = Mg2++2NO3- D.Na2SO4 = 2Na++SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com