
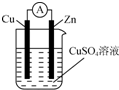
 将锌棒和铜棒按图示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是( )
将锌棒和铜棒按图示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是( )| A. | 该装置是将电能转化为化学能 | |
| B. | 锌棒为正极 | |
| C. | 电子由铜棒流出 | |
| D. | 该电池总反应为Zn+CuSO4═ZnSO4+Cu |
分析 该装置能自发的进行氧化还原反应,能将化学能转化为电能,属于原电池,Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为Cu2++2e-=Cu,电子从负极沿导线流向正极,以此解答该题.
解答 解:A.该装置是将化学能转化为电能的装置,属于原电池,故A错误;
B.Zn易失电子作负极,故B错误;
C.该装置中Zn易失电子作负极、Cu作正极,电子从负极Zn沿导线流向正极Cu,所以电子从锌棒流出,故C错误;
D.该装置电池反应式与锌和硫酸铜发生置换反应方程式相同,为Zn+CuSO4═ZnSO4+Cu,故D正确;
故选D.
点评 本题考查了原电池原理,根据能量转化方式确定装置类型,再结合正负极上发生的反应及电子流向分析解答,知道原电池正负极的判断方法,题目难度不大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题

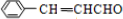 ;
;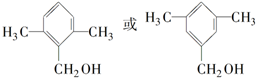 ;
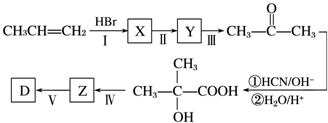
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中 Cl-、$NO_3^-$、Na+、$SO_3^{2-}$ | |
| B. | c(H+)=1.0×10-13mol•L-1溶液中 ${C_6}{H_5}{O^-}$、K+、$SO_4^{2-}$、Br- | |
| C. | Na2S溶液中 $SO_4^{2-}$、K+、Cl-、Cu2+ | |
| D. | pH=12的溶液中 $NO_3^-$、I-、Na+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中存在电离平衡:(NH4)2SO4?2NH4++SO42- | |
| B. | 向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大 | |
| C. | 加水稀释,溶液中所有离子的浓度均减小 | |
| D. | 溶液中:c(SO42-)=2c(NH4+)+2c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.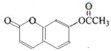 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 分馏石油得到的各馏分都是纯净物 | |
| C. | C4H10有2种同分异构体 | |
| D. | 蛋白质水解和油脂皂化都是高分子转化成小分子的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com