
分析 (1)金属性越强,与水反应越剧烈;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)非金属性越强,对应氢化物越稳定;
(4)最高价氧化物对应水化物中高氯酸的酸性最强;
(5)金属离子电荷越小、离子半径越大,金属单质中熔点越低;非金属单质中沸点最低的是氢气;
(6)最外层电子数是次外层电子数3倍,原子只能有2个电子层,最外层电子数为6;
(7)最外层电子数是次外层电子数的$\frac{3}{8}$,则次外层电子数为8,原子有3个电子层,最外层电子数为3;
(8)原子符号为AZX,左下角Z为质子数,左上角A为质量数,其中质量数=质子数+中子数.
解答 解:(1)短周期中Na的金属性最强,与水反应越剧烈,故答案为:Na;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,一般电子层数越大原子半径越大,故短周期中Na的原子半径最大,H原子半径最小,故答案为:Na;H;
(3)F元素非金属性最强,故HF最稳定,故答案为:HF;
(4)氯元素最高价氧化物对应水化物--高氯酸的酸性最强,故答案为:Cl;
(5)金属离子电荷越小、离子半径越大,金属单质中熔点越低,故Na的熔点最低价,非金属单质中沸点最低的是氢气,故答案为:Na;H2;
(6)最外层电子数是次外层电子数3倍,由于最外层电子数不能超过8,故原子只能有2个电子层,最外层电子数为6,则为O元素,故答案为:O;
(7)最外层电子数是次外层电子数的$\frac{3}{8}$,则次外层电子数为8,原子有3个电子层,最外层电子数为3,故为Al,故答案为:Al;
(8)含有8个质子、10个中子的原子为O原子,该原子质量数为8+10=10,故该原子符号为188O,故答案为:188O.
点评 本题考查元素周期律应用及原子构成,比较基础,注意对元素周期律的理解掌握,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 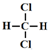 和 和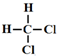 | B. | CH2=CH-CH=CH2和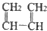 | ||
| C. | C(CH3)3C(CH3)3和CH3(CH2)3C(CH3)3 | D. | 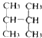 和 和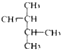 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g氧气和臭氧(O3)混合气体中含有氧原子的数目为2NA | |
| B. | 标准状况下,4.48 L水中含有H2O分子的数目为0.2NA | |
| C. | 1 mol铁与足量的硝酸反应,生成H2分子的数目为NA | |
| D. | 0.2 mol•L-1 CaCl2溶液中含有Cl-离子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定盛待测液的锥形瓶中有少量水对滴定结果无影响,锥形瓶不能用待测液润洗 | |
| B. | 酸式和碱式滴定管用蒸馏水洗净后还需用标准液或待测液润洗 | |
| C. | 滴定时左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶中颜色变化 | |
| D. | 滴定前仰视读数,滴定后平视刻度读数,被测待测溶液偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | pH=1的溶液中:Fe2+、NO3-、AlO2-、Na+ | |
| C. | 水电离出的c(H+)=10-12 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦⑧ | B. | ②③⑤⑧⑩ | C. | ①③④⑥⑨ | D. | ②⑤⑦⑨⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com