
【题目】下列室温下的溶液中,有关溶液中各粒子的浓度关系判断正确有
①0.1 mol·L-1CH3COOH溶液中:c(CH3COO-)=c(H+) - c(OH-)
②0.1 mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(NH![]() )>c(SO
)>c(SO![]() )>c(Cu2+)>c(H+)>c(OH-)
)>c(Cu2+)>c(H+)>c(OH-)
③等体积、等物质的量浓度的弱酸HX和NaX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
④pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+) >c(OH-)
⑤0.1 mol/L Na2CO3溶液中:c(OH-)=c(HCO![]() )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
⑥向醋酸钠溶液中加入醋酸,得到的酸性混合溶液中:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
⑦pH=7的NH3—NH4Cl混合溶液中:c(NH![]() )=c(Cl-)
)=c(Cl-)
⑧0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
A. 3个 B. 4个 C. 5个 D. 6个
【答案】A
【解析】试题分析:①0.1 mol·L-1CH3COOH溶液中存在电荷守恒式为c(CH3COO-)+ c(OH-)=c(H+),则c(CH3COO-)=c(H+) - c(OH-),故①正确;②0.1 mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中因Cu2+和NH4+的水解溶液显酸性,但水解程度均较弱,则c(SO![]() )>c(NH
)>c(NH![]() )>c(Cu2+)>c(H+)>c(OH-),故②错误;③等体积、等物质的量浓度的弱酸HX和NaX混合后的溶液可能显酸性也可能显碱性,故③错误;④pH=2的HA溶液与pH=12的MOH溶液以任意比混合存在电荷守恒式c(H+)+c(M+)=c(OH-)+c(A-),则c(H+)+c(M+) >c(OH-),故④正确;⑤0.1 mol/L Na2CO3溶液中存在的质子守恒式为c(OH-)=c(HCO
)>c(Cu2+)>c(H+)>c(OH-),故②错误;③等体积、等物质的量浓度的弱酸HX和NaX混合后的溶液可能显酸性也可能显碱性,故③错误;④pH=2的HA溶液与pH=12的MOH溶液以任意比混合存在电荷守恒式c(H+)+c(M+)=c(OH-)+c(A-),则c(H+)+c(M+) >c(OH-),故④正确;⑤0.1 mol/L Na2CO3溶液中存在的质子守恒式为c(OH-)=c(HCO![]() )+c(H+)+2c(H2CO3),故⑤错误;⑥向醋酸钠溶液中加入醋酸,得到的酸性混合溶液中存在电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)>c(CH3COO-)>c(H+)>c(OH-)肯定不成立,故⑥错误;⑦NH3—NH4Cl混合溶液中存在电荷守恒c(NH
)+c(H+)+2c(H2CO3),故⑤错误;⑥向醋酸钠溶液中加入醋酸,得到的酸性混合溶液中存在电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)>c(CH3COO-)>c(H+)>c(OH-)肯定不成立,故⑥错误;⑦NH3—NH4Cl混合溶液中存在电荷守恒c(NH![]() )+c(H+)=c(Cl-)+c(OH-),当pH=7时c(NH
)+c(H+)=c(Cl-)+c(OH-),当pH=7时c(NH![]() )=c(Cl-),故⑦正确;⑧0.1 mol·L-1的NaHA溶液,其pH=4说明HA-电离大于HA-水解,则c(HA-)>c(H+)>c(A2-)>c(H2A),故⑧错误;答案为A。
)=c(Cl-),故⑦正确;⑧0.1 mol·L-1的NaHA溶液,其pH=4说明HA-电离大于HA-水解,则c(HA-)>c(H+)>c(A2-)>c(H2A),故⑧错误;答案为A。


 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | ||
III | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
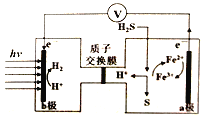
A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最简式相同,但既不是同系物,又不是同分异构体的是
①辛烯和3-甲基-1-丁烯
②苯和乙炔
③1-氯丙烷和2—氯丙烷
④甲基环己烷和乙烯
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(1)ΔH=-67.7kJ·mol-1,
② H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ·mol-1。在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,下列有关说法不正确的是( )
A. 氢氟酸的电离方程式及热效应可表示为:HF(aq)![]() F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
F-(aq)+ H+(aq) ΔH=-10.4kJ·mol-1
B. 当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C. 当V=20时,溶液中:c(F-)<c(Na+)=0.1mol·L-1
D. 当V>0时,溶液中可能存在:c(Na+)>c(F-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工的一种产品A(乙烯)为主要原料合成一种具有果香味的物质E的生产流程如下:
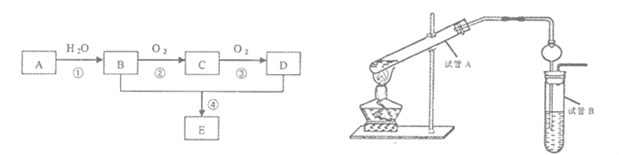
(1)写出步骤①的化学方程式_______________反应类型__________;
步骤②的化学方程式______________反应类型__________;
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式_______________________;
②试管B中的试剂是______________________;分离出乙酸乙酯的实验操作是______________(填操作名称),用到的主要玻璃仪器为____________________;
③插入右边试管的导管接有一个球状物,其作用为_______________________。
(3)为了制备重要的有机原料——氯乙烷(CH3—CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:
CH3—CH3+Cl2 ![]() CH3—CH2Cl+HCl
CH3—CH2Cl+HCl
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:
CH2=CH2+HCl→CH3—CH2Cl
你认为上述两位同学的方案中,合理的是____,简述你的理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸(HCOOH)是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
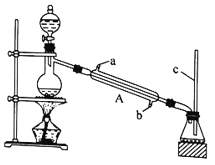
I.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度(g·cm-3) | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是_________________,长玻璃管c的作用是__________________________。
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________________________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为__________________________________。
II.甲酸能脱水制取一氧化碳

(1)利用上图装置制备并收集CO气体,其正确的连接顺序为a→__________(按气流方向从左到右,用小写字母表示)。
(2)装置B的作用是__________________________________。
(3)一定条件下,CO能与NaOH固体发生反应:CO+NaOH ![]() HCOONa。
HCOONa。
①为了证明“CO与NaOH固体发生了反应”,设计下列定性实验方案:取固体产物,配成溶液,___________。
②测定产物中甲酸钠(HCOONa)的纯度:准确称取固体产物8,0g配制成100mL溶液,量取20.00mL该溶液于锥形瓶中,再加入___________作指示剂,用1.5mol/L的盐酸标准溶液滴定剩余的NaOH,平行滴定三次,平均消耗盐酸的体积为5.05mL,则产物中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com