
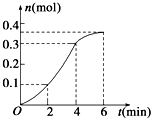
| A. | 反应开始2 min内平均反应速率最大 | |
| B. | 反应速率先增大后减小 | |
| C. | 反应2 min到第4 min内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 |
分析 根据$\frac{△n}{△t}$知,相同时间内二氧化碳物质的量变化量越大其反应速率越大;该反应的正反应是放热反应,反应过程中溶液温度升高、溶液浓度降低,反应物浓度越大、溶液温度越高,反应速率越大,据此分析解答.
解答 解:A.由$\frac{△n}{△t}$知,相同时间内二氧化碳物质的量变化量越大其反应速率越大,根据图知,相同时间内物质的量变化量最大的是2-4min内,所以2-4min内平均反应速率最大,故A错误;
B.由$\frac{△n}{△t}$知,相同时间内二氧化碳物质的量变化量越大其反应速率越大,根据图知,相同时间内物质的量变化大小顺序是2-4min>0-2min>4-6min,所以反应速率先增大后减小,故B正确;
C.该反应的正反应是放热反应,反应过程中溶液温度升高、溶液浓度降低,反应物浓度越大、溶液温度越高,反应速率越大,随着反应减小溶液浓度减小但溶液温度升高,2-4min内反应速率大于0-2min内,所以说明温度影响反应速率大于浓度变化,故C正确;
D.根据图知,反应在第2 min到第4 min内生成CO2的物质的量变化量大于前2min物质的量变化量,所以平均反应速率为前2 min的2倍,故D正确;
故选A.
点评 本题考查图象分析,侧重考查学生分析判断能力,明确图象中曲线变化趋势及其斜率含义是解本题关键,注意该曲线斜率体现反应速率快慢,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下pH为5的盐酸溶液稀释1000倍后,pH等于8 | |
| B. | 碳酸钠溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | 浓度均为0.1mo1•L-l的氨水和氯化铵溶液,水电离出的c(H+)前者和后者相同 | |
| D. | 等浓度的CH3COOH与KOH以任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| B. | X可能形成化学式为KXO3的含氧酸钾盐 | |
| C. | X能形成化学式为X(OH)3的碱 | |
| D. | X能与某些金属元素形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以X浓度变化表示的反应速率为0.3 mol/(L•min) | |
| B. | 12 s后将容器体积扩大为10 L,Z的平衡浓度变为原来的$\frac{1}{5}$ | |
| C. | 若增大X的浓度,则物质Y的转化率减小 | |
| D. | 经12 s达到平衡后,2v(X)=v(Z) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4g 氦气 | B. | 1.25mol O2 | ||
| C. | 22.4升 Cl2(标准状况) | D. | 6.02×1023个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O的摩尔质量为18g | |
| B. | 1mol O2的质量为32g•mol-1 | |
| C. | 相同质量的O2和O3,所含分子数不同,所含原子数相同 | |
| D. | 相同物质的量的CO2 和CO,所含O原子的个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A,B,C,D,E五种物质可按图所示发生转变(反应条件已略去).
A,B,C,D,E五种物质可按图所示发生转变(反应条件已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com