
(1)在Na2CO3溶液中逐滴加入盐酸,直至过量。反应过程中c(![]() )的变化是___________。反应的离子方程式为____________________,____________________。
)的变化是___________。反应的离子方程式为____________________,____________________。
(2)向含溶质a mol的Na2CO3溶液中逐滴加入含溶质b mol的盐酸。如果无气体放出,则a_________b(填>、=、<),如果放出a mol气体,则a、b的关系为____________________;
如果放出气体的物质的量大于0,小于a mol,则a、b的关系为______________________。
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:
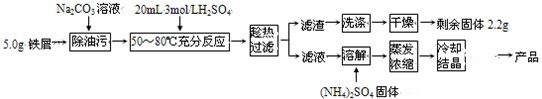 (2009?广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:
(2009?广州模拟)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下: HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com