
【题目】化学上常用燃烧法确定有机物的组成。如下图所示装置是用燃烧法确定有机物化学式常用的装置,这种方法是电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
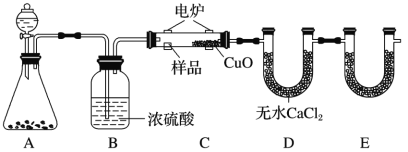
回答下列问题:
(1)A装置分液漏斗中盛放的物质是_______,写出有关反应的化学方程式:________。
(2)C装置(燃烧管)中CuO的作用是__________。
(3)写出E装置中所盛放试剂的名称:________,它的作用是__________。
(4)若将B装置去掉会对实验造成什么影响?________。
(5)若准确称取 18.0g样品(只含 C、H、O 三种元素中的两种或三种),经充分燃烧后,E管质量增加26.4g,D 管质量增加 10.8g,则该有机物的最简式为__________。
(6)要确定该有机物的分子式,还需要测定______,目前最精确、最快捷的测定方法是________。称取A物质18.0g,升温使其汽化,测其密 度是相同条件下H2的45倍。试通过计算填空:A的相对分子质量为______。
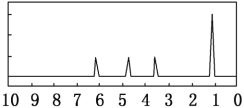
(7)另取A18.0g与足量的NaHCO3粉末反应,生成0.2mol CO2,若与足量钠反应则生成 0.2molH2。若核磁共振氢谱如下图,则该分子可能为__________(填结构简式),其中所含官能团的名称______。确定该有机物的物理方法是_______。
【答案】H2O2(或双氧水) 2H2O2![]() 2H2O+O2↑ 使有机物充分氧化生成CO2和H2O 碱石灰或氢氧化钠 吸收CO2气体 若将B装置去掉,A中生成的氧气中含有水蒸气进入D装置,造成测得有机物中含氢量增大 CH2O 有机物的相对分子质量 质谱法 90
2H2O+O2↑ 使有机物充分氧化生成CO2和H2O 碱石灰或氢氧化钠 吸收CO2气体 若将B装置去掉,A中生成的氧气中含有水蒸气进入D装置,造成测得有机物中含氢量增大 CH2O 有机物的相对分子质量 质谱法 90 ![]() 羧基、羟基 红外光谱法
羧基、羟基 红外光谱法
【解析】
(1)A用来制取反应所需的氧气根据装置图分析判断发生的反应;B用来吸收水;
(2)根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳;
(3)E用来吸收反应中产生的二氧化碳气体;
(4)若将B装置去掉,A中生成的氧气中含有水蒸气进入D装置;
(5)浓硫酸吸收水,碱石灰可以吸收二氧化碳,根据元素守恒来确定有机物的分子式;
(6)要确定该有机物的化学式,还需要测出有机物的相对分子质量。目前最精确、最快捷的测定方法是质谱法相同条件下,气体的相对分子质量之比等于密度之比;
(7) A和碳酸氢钠反应说明A中含有羧基,与足量金属钠反应则生成0.2molH2,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2:1,A与钠反应时,A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个羧基外还含有一个羟基,峰面积之比等于氢原子的数目之比,结合以上分析确定A的结构简式。
(1)双氧水可分解生成氧气,A装置中分液漏斗盛放的物质是H2O2(或双氧水),化学方程式为2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(3)E装置中所盛放物质最好选用碱石灰或氢氧化钠,因为氢氧化钠可以完全吸收反应生成的二氧化碳,故盛放物质为碱石灰或氢氧化钠.它的作用是吸收CO2气体;
(4)若将B装置去掉,A中生成的氧气中含有水蒸气进入D装置,导致造成测得有机物中含氢量增大;
(5)18.0gA的物质的量=![]() =0.2mol,浓硫酸增重10.8g,则生成水的质量是10.8g,生成n(H2O)=
=0.2mol,浓硫酸增重10.8g,则生成水的质量是10.8g,生成n(H2O)=![]() =0.6mol,所含有n(H)是1.2mol,碱石灰增重26.4g,生成m(CO2)是26.4g,n(CO2)=
=0.6mol,所含有n(H)是1.2mol,碱石灰增重26.4g,生成m(CO2)是26.4g,n(CO2)=![]() =0.6mol,所以n(C)是0.6mol,则n(A):n(C):n(H)=0.2mol:0.6mol:1.2mol=1:3:6,则有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3,故该有机物的最简式为CH2O;
=0.6mol,所以n(C)是0.6mol,则n(A):n(C):n(H)=0.2mol:0.6mol:1.2mol=1:3:6,则有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3,故该有机物的最简式为CH2O;
(6)要确定该有机物的化学式,还需要测出有机物的相对分子质量。目前最精确、最快捷的测定方法是质谱法;有机物质的密度是相同条件下H2的45倍,所以有机物质的相对分子质量=45×2=90;
(7)18.0gA的物质的量=![]() =0.2mol,A和碳酸氢钠反应说明A中含有羧基,生成0.2molCO2,所以含有一个羧基;醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成0.2molH2,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2:1,A与钠反应时,A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个羧基外还含有一个羟基,根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,且氢原子的个数比是3:1:1:1,所以结构简式为:
=0.2mol,A和碳酸氢钠反应说明A中含有羧基,生成0.2molCO2,所以含有一个羧基;醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成0.2molH2,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2:1,A与钠反应时,A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个羧基外还含有一个羟基,根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,且氢原子的个数比是3:1:1:1,所以结构简式为:![]() ;可通过红外光谱法确定其官能团和化学键。
;可通过红外光谱法确定其官能团和化学键。


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
 。
。
I、制备草酸亚铁晶体:
①称取硫酸亚铁铵晶体5g,放入250mL三颈烧瓶中,加入10滴左右1.0mol·L-1H2SO4溶液和15mL蒸馏水加热溶解;
②加入25mL饱和草酸溶液,加热搅拌至沸,停止加热,静置;
③待黄色晶体FeC2O4·2H2O沉淀后倾析,洗涤,加入约20mL蒸馏水搅拌并温热5min,静置,弃去上层清液,即得黄色草酸亚铁晶体。
回答下列问题:
(1)仪器B的作用是___;
(2)硫酸亚铁铵晶体用硫酸溶解的原因是___;
(3)硫酸亚铁铵晶体可能混有一定Fe3+,羟胺(NH2OH,酸性条件下以NH3OH+形式存在)具有强还原性,在酸性条件下可用羟胺去除亚铁盐中的Fe3+。写出相关的离子方程式:__;
II、探究草酸亚铁的纯度:
①准确称取mg草酸亚铁固体样品(含有草酸铵杂质),溶于25mL2mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100mL容量瓶配成100.00mL溶液;
②用___滴定管(填“酸式”、“碱式”)取上述溶液20.00mL,用KMnO4标准溶液(浓度为cmol·L-1)滴定三次,平均消耗V1mL;
③在②反应后的溶液中加入适量锌粉和2mL2 mol·L-1H2SO4溶液,反应一段时间后,取1滴试液放在点滴板上检验,至Fe3+极微量;
④过滤除去锌粉,滤液收集在另一个锥形瓶中,将滤纸及残余物充分洗涤,洗涤液并入滤液中,再补充约2~3mL2mol·L-1 H2SO4溶液,继续用KMnO4标准溶液(浓度为cmol·L-1)滴定至终点,共平行测定三次,平均消耗V2mL。
回答下列问题:
(4)在②中溶液中发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O,还有另一氧化还原反应,写出其离子方程式__。
(5)加入适量锌粉的目的是___;步骤③中检验其中微量的Fe3+的试剂是__(用化学式表示)溶液。步骤④用KMnO4标准溶液滴定至终点的现象是___。
(6)计算mg固体样品的纯度为__(用含c、V2的式子表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业的核心反应是N2(g)+3H2(g) ![]() 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。
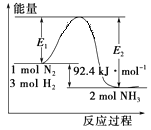
(1)该反应的ΔH=_______kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1 _____(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量_________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:P4(s,白磷)+5O2 (g)= P4O10 (s)ΔH1=-2983.2 kJ/mol 4P(s,红磷)+ 5O2 (g) = P4O10 (s) ΔH2 =-2954kJ/mol,则该温度下白磷转化为红磷的热化学方程式:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是

A. 制取氨气,可选用②③
B. 分离 NaHCO3,可选用④⑤⑦
C. 制取 Na2CO3,可选用①②⑦⑧
D. 制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.Fe3O4(s) ![]() Fe(s)
Fe(s) ![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
B.Al2O3 ![]() AlCl3(aq)
AlCl3(aq) ![]() 无水AlCl3
无水AlCl3
C.Fe2O3(s) ![]() Fe(s)
Fe(s) ![]() FeCl3(aq)
FeCl3(aq)
D.CuSO4(aq) ![]() Cu(OH)2
Cu(OH)2![]() CuO
CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法中正确的是( )
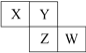
A.W的原子序数不可能是X的原子序数的3倍
B.Z元素可能是金属元素
C.四种元素的原子有可能均能与氢原子形成18电子分子
D.W的气态氢化物的稳定性一定比Y的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中,发生反应:X2(g)+Y2(g)![]() 2Z(g),某时刻测得容器内X2、Y2、Z的浓度分别为0.2mol/L、0.4mol/L、0.4mol/L,则当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),某时刻测得容器内X2、Y2、Z的浓度分别为0.2mol/L、0.4mol/L、0.4mol/L,则当反应达到平衡时,各物质的浓度有可能是( )
A.c(X2)=0.4mol/LB.c(Y2)=0.2mol/L
C.c(Z)=0.6mol/LD.c(Y2)=0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.含硫的煤燃烧时会产生SO2,对空气造成污染,且易形成酸雨。
(1)为了防治酸雨,工业上常用生石灰和含硫的煤混合后燃烧,燃烧时生成的SO2和生石灰、O2共同反应生成硫酸钙。请写出该反应的化学方程式___。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
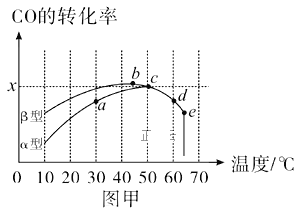
(2)a、b、c、d四点中,达到平衡状态的是__。
(3)已知c点时容器中O2浓度为0.02mol/L,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=__(用含x的代数式表示)。
(4)下列关于图甲的说法正确的是__。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高至一定温度后,催化剂失去活性
Ⅲ.活性炭还原法也是消除氮氧化物和硫氧化物的方法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:
C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=QkJ·mol-1
N2(g)+CO2(g) ΔH=QkJ·mol-1
在T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.40 | 0.20 | 0.30 | 0.60 | |
N2 | 0 | 0.40 | 0.60 | 0.60 | ||
CO2 | 0 | 0.60 | 0.60 |
(5)0~10min内,N2的平均反应速率v(N2)=__。
(6)若30min后升高温度至T2℃,重新达到平衡时,容器中NO、N2、CO2的浓度之比为7∶3∶3,则该反应的ΔH__0(填“>”、“=”、或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com