


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.法国化学家拉瓦锡建立燃烧现象的氧化学说使近代化学取得了革命性进展 |
| B.英国化学家在世界上首次合成了具有生物活性的蛋白质-------牛胰岛素 |
| C.以碳及其化合物为原料制成的芯片和光导纤维引领我们进入了信息时代 |
| D.经过化学家们的不断努力,从自然界中发现以及人工制造出的化合物已经超过3500万种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学是一门以实验为基础的自然科学 |
| B.化学家可以制造出自然界中不存在的物质 |
| C.物质发生化学反应都伴随着能量变化 |
| D.化学研究会造成严重的环境污染,人类终将毁灭在化学物质中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
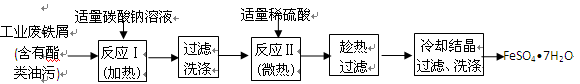
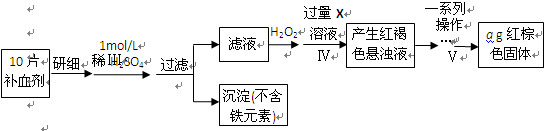
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
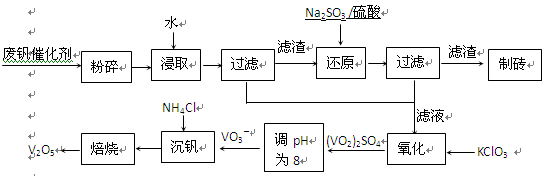
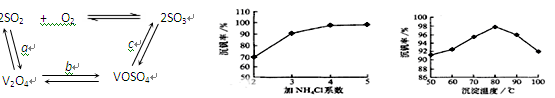
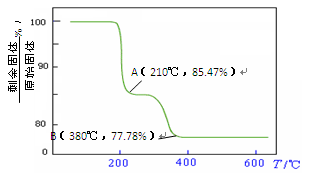
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
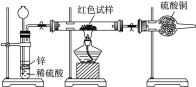
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com