
【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出这四种元素的元素符号:T_______;X_______;Y_______;Z_______。
(2)写出元素T的原子结构示意图_____________________________
(3)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是__________(填序号)。
①Y单质的熔点比Z单质低 ②Y的化合价比Z低
③Y单质与水反应比Z单质剧烈 ④Y最高价氧化物的水化物的碱性比Z强
(4)X元素的气态氢化物与其最高价含氧酸反应的方程式为______________________
(5)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式________________________________________
【答案】O N Na Al ![]() Na ③④ NH3+HNO3=NH4NO3 N2H4+2H2O2=N2+4H2O
Na ③④ NH3+HNO3=NH4NO3 N2H4+2H2O2=N2+4H2O
【解析】
T原子最外层电子数是次外层电子数的3倍,由最外层电子数不超过8个可知T原子最外层电子数为6,则T是O元素;X常温下单质为双原子分子,分子中含有3对共用电子对,则X为N元素;Y元素M层比K层少1个电子, Y元素原子序数是2+8+1=11,则Y为Na元素;Z元素在第3周期金属元素的简单离子中半径最小,则Z是Al元素。
(1)由分析可知,T是O元素、X为N元素、Y为Na元素、Z是Al元素,故答案为:O;N;Na;Al;
(2)O原子核外有2个电子层、最外层电子数是6,原子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(3)同一周期元素,元素的金属性随着原子序数增大而减弱,所以Na的金属性大于Al;
金属的金属性强弱判断方法有金属与水或水置换出氢气的难易程度、金属之间的置换反应、其最高价氧化物的水化物碱性强弱,则能证明钠的金属性大于Al的有Y单质与水反应比Z单质剧烈、Y最高价氧化物的水化物的碱性比Z强,故选③④,故答案为:Na;③④;
(4)N元素的气态氢化物为氨气,最高价含氧酸为硝酸,氨气与硝酸反应生成硝酸铵,化学方程式为NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3;
(5)O元素和氢元素以原子个数比1∶1化合形成化合物为H2O2,N元素与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物为N2H4,N2H4与H2O2发生氧化还原反应生成氮气和水,反应的化学方程式为N2H4+2H2O2=N2+4H2O,故答案为:N2H4+2H2O2=N2+4H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为____________个;
(2)该气体在标准状况下的体积为____________L;
(3)该气体每个分子的质量为_______________g;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
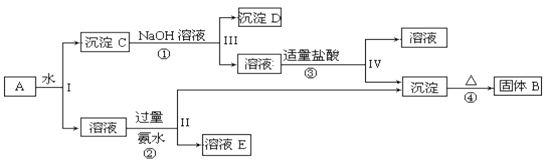
据此回答下列问题:
(1)I、II、III、IV四步操作采取的分离方法是___________________。
(2)根据上述框图反应关系,写出下列B、C、E所含物质的化学式沉淀固体B________________;C______________________;E_______________
(3)写出①、②、④三个反应方程式(有离子反应的写离子方程式,没有的写化学方程式)
①____________________________ ② ____________________________
④__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
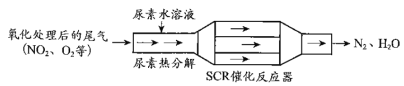
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式___________________。
②反应器内NH3还原NO2过程中,若还原产物比氧化产物少1mol,转移电子总数__________个(用NA表示)。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成_________。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
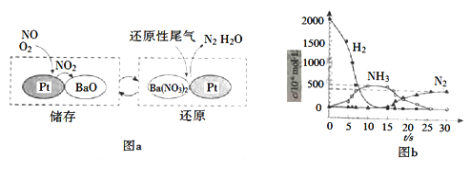
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是___。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:_____________![]() 15NNO+H2O
15NNO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A ![]() CH2=C(CH3)COOCH3,下列说法正确的是
CH2=C(CH3)COOCH3,下列说法正确的是
A. 已知该反应的原子利用率为100%,则A为CO2
B. CH3OH和甘油互为同系物
C. CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D. 能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
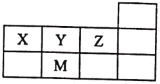
A. 原子半径:M>Z>Y>X
B. Z的气态氢化物最稳定,因其分子间存在氢键
C. 最高价氧化物对应水化物的酸性M<Z
D. 元素的非金属性:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按![]() X(X为元素符号)格式写出含有8个质子、10个中子的原子的化学符号:_________。
X(X为元素符号)格式写出含有8个质子、10个中子的原子的化学符号:_________。
(2)根据下列微粒回答问题:![]() H、
H、![]() H、
H、![]() H、14C、14N、16O、35Cl2、37Cl2。
H、14C、14N、16O、35Cl2、37Cl2。
①以上8种微粒共有________ 种核素,共________ 种元素。
②互为同位素的是________ 。
③质量数相等的是________ 和________ ,中子数相等的是________ 和________ 。
(3)相同物质的量的14CO2与S18O2的质量之比为________;电子数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q、W为前四周期元素,原子序数依次增大。元素Y在地壳中含量最高,W的一种常见高价氧化物是红棕色粉末,常用于油漆、涂料、油墨的红色染料,25℃X、Z、J、Q的最高价氧化物对应水化物溶液(浓度均为0.01mol·L-1)的pH与原子序数的关系如图所示。
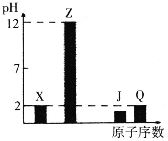
根据上述信息进行判断,并回答下列问题:
(1)W在周期表中的位置__。比较X、Y、Z的简单离子半径大小为__<____<__(用离子符号表示);
(2)元素的非金属性Y__J(填“>”或“<”)。下列各项中,不能说明这一结论的有__(填序号)。
A.J的氢化物的水溶液放置在空气中会变浑浊
B.Y与J之间形成的化合物中元素的化合价。
C.Y和J的单质的状态
D.Y和J在周期表中的位置
(3)X、J、Q这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_____(填化学式);酸根呈三角锥结构的酸是___(填化学式)。
(4)Y和Q形成的化合物Q2Y的立体构型为__,Q的单质与湿润的Na2CO3反应可制备Q2Y,其化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com