
| A. | 质量数是89 | B. | 质子数与中子数之差为50 | ||
| C. | 核外电子数是39 | D. | ${\;}_{39}^{89}$Y与${\;}_{39}^{90}$Y互为同位素 |
分析 原子中质子数、中子数、质量数之间的关系为质量数=质子数+中子数,原子中的质子数与电子数的关系为核电荷数=核外电子数=核内质子数,同位素是指质子数相同中子数不同的同种元素的不同原子互称同位素.
解答 解:A.原子符号左上角为质量数,所以钇原子质量数为89,故A正确;
B.质子数+中子数=质量数,中子数=质量数-质子数=89-39=50,质子数与中子数之差为50-39=11,故B错误;
C.原子的核外电子数=核内质子数,所以核外有39个电子,故C正确;
D.${\;}_{39}^{89}$Y与${\;}_{39}^{90}$Y质子数相同,质子数不同互为同位素,故D正确;
故选B.
点评 本题考查的是有关质子数、中子数、电子数之间的计算,以及同位素的定义,是小型综合题,属基础知识,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
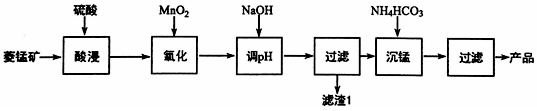
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
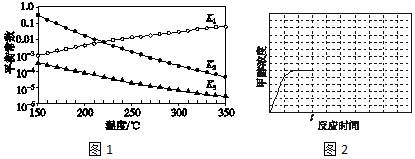
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个H+的质量为1 g | |
| B. | 2 L 0.5 mol/L Na2SO4溶液中含NA个Na+ | |
| C. | 32 g O2中含有2NA个氧原子 | |
| D. | 标准状况下,1 mol H2O中含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的转化率为60% | B. | 反应速率v(Y)=0.3 mol/(L•min) | ||
| C. | a的值为2 | D. | 平衡时X的浓度为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
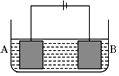 按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )| A. | 4:1 | B. | 3:1 | C. | 2:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(CO2) | n(H2) | n(CH3OH(g) | n(H2O(g) | |
| 0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
| 5min | 0.50mol | 0.50mol | ||
| 10min | 0.25mol | 0.75mol | ||
| 15min | 0.25mol | n1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com