
分析 A、B、C均为短周期元素,A的P能级上只有一对成对电子,则P能级上有4个电子,则A为C元素,B、C两种元素组成的五原子一价阳离子含10个电子,则该离子为铵根离子,A和B是同周期相邻的两种元素,则B为N元素,C为H元素,据此答题.
解答 解:A、B、C均为短周期元素,A的P能级上只有一对成对电子,则P能级上有4个电子,则A为C元素,B、C两种元素组成的五原子一价阳离子含10个电子,则该离子为铵根离子,A和B是同周期相邻的两种元素,则B为N元素,C为H元素,
(1)A为C元素,A元素的电子排布式为 1s22s22p4 ,
故答案为:1s22s22p4;
(2)A、B、C可组成化学式C4B2A3的物质为NH4NO3,是离子化合物,
故答案为:离子;
(3)B、C两种元素组成的五原子离子为NH4+,其中氮原子杂化方式为 sp3,该离子的空间构型为 正四面体形,
故答案为:sp3;正四面体形;
(4)化合物NH3是极性分子,故答案为:极性.
点评 本题主要考查了电子排布式、原子杂化方式、分子空间构型、物质的分类等知识,中等难度,有一定的综合性,元素推断是解题的关键,答题时注意常见化学用语的正确表达,审题要仔细.


科目:高中化学 来源: 题型:选择题
 和
和 代表不同元素的原子.
代表不同元素的原子.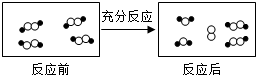
| A. | 一定属于吸热反应 | B. | 一定属于可逆反应 | ||
| C. | 一定属于氧化还原反应 | D. | 一定属于分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝是一种既可以与强酸反应又可以与强碱反应的金属 | |
| B. | 氧化铝按组成划分属于金属氧化物,按性质划分属于碱性氧化物 | |
| C. | 氢氧化铝具有较高的熔点和沸点,常用于制造耐火材料 | |
| D. | 铝是地壳中含量最多的元素,铝土矿是铝元素在地壳中的主要存在形式之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向卤代烃的水解液中直接加入 AgNO3溶液,可以确定卤代烃中卤元素 | |
| B. | CH2Cl2的结构只有一种证明 CH4是正四面体结构而不是平面正方形结构 | |
| C. | 通过石油化学工业中的催化重整等工艺可以获得芳香烃 | |
| D. | 邻二氯苯不存在同分异构体说明苯分子中 6个碳原子之间的键是一样的 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
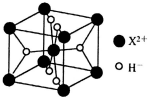 W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.
W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com