
��1����ʱ��Һ����������ǵ�һ�ɷ֣�������________________������Ƕ��ֳɷ֣�������_______________��
��2��������������Һ�У���λ����μ�1 mol��L -1�����ᣬ�������壨�������ܽ���ˮ������������ӵ�����������ϵ����ͼ��ʾ��
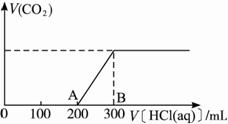
�ټ�������200 mL֮ǰ�������������д��OA�η�����Ӧ�����ӷ���ʽ__________________��
�ڲ�����CO2�ڱ�״���µ����Ϊ_____________mL��
��B��ʱ����Ӧ������Һ�����ʵ����ʵ���Ũ���� ______________mol��L -1(��Һ����ı仯���Բ���)��
��1��Na2CO3��NaHCO3 NaOH��Na2CO3��Na2CO3��NaHCO3?
��������OH -+H +�T�TH2O��
CO![]() +H +�T�THCO
+H +�T�THCO![]() ��
��
��2240��
��0.75
������2NaOH+CO2�T�TNa2CO3+H2O��?
NaOH+CO2�T�TNaHCO3��?
(1)��Ӧ���������Ϊ��һ�ɷ֣�����Һ��pH��7,�����ΪNa2CO3��NaHCO3�����Ƕ��ֳɷ֣�����ΪNaOH��Na2CO3�Ļ�����![]() ��2ʱ��NaOH��ʣ�ࡳ��Ҳ����ΪNa2CO3��NaHCO3�Ļ�����2��
��2ʱ��NaOH��ʣ�ࡳ��Ҳ����ΪNa2CO3��NaHCO3�Ļ�����2��![]() ��1ʱ����
��1ʱ����
��2����ͼOA����CO2�ų�����֪������Һ�ڸù�����һ�������������ᷴӦ������CO2�����ʡ�?
�ۺ�����4�������������ΪNa2CO3��NaOH��Na2CO3�Ļ����ʱ������OA�ε�ͼ��仯��
���ۣ�?
�ٵ�������ҺΪ��һ����Na2CO3ʱ��?
2NaOH + CO2 �T�T Na2CO3 + H2O?
0.1 L��3 mol��L -1? 0.15 mol?
Na2CO3��+��HCl �T�T NaHCO3+NaCl?
0.15 mol 0.15 mol?
��Ӧ��0.15 mol Na2CO3����NaHCO3��1 mol��L -1������150 mL����ͼ����A���200 mL���������������ò�����ΪNa2CO3��Һ��ֻ����NaOH��Na2CO3�Ļ��Һ��?
����Һ��NaOH��Na2CO3�����ʵ����ֱ�Ϊx��y��?
OA�Σ�NaOH + HCl �T�T NaCl+H2O
? x=0.1 mol 0.2 L��1 mol��L -1-0.1 mol?
Na2CO3��+��HCl �T�T NaHCO3+NaCl?
?y=0.1 mol 0.1 mol 0.1 mol?
AB�Σ�?
NaHCO3 + HCl���T�T��NaCl + CO2��+H2O?
0.1 mol��0.1 L��1 mol��L -1?��0.1 mol?
��Na +�غ㣬��֪��Ӧ��ȫ������NaCl 0.3 mol,��Һ�����Ϊ100 mL+300 mL=400 mL=0.4 L��?
c��NaCl��=![]() =0.75 mol��L -1
=0.75 mol��L -1



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ũ�����������������̹�����ȡ���� | B����״���£���1 g��ƬͶ��20 mL 18.4 mol/L�������� | C����100 mL 3 mol/L�������м���5.6 g�� | D�����¡���ѹ���д��������£���1 mol������4 mol�����ϳɰ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ2010-2011ѧ�������ѧ�����п��ԣ����ۣ���ѧ���� ���ͣ�ѡ����
�ڸ��������£����мӵ�������ڻ�ѧ��Ӧ���ܱ���ȫ���ĵ��� �� ��
|
A����100 mL 3 moI��L��1���������5.6g�� |
|
B����״���£���1g��ƬͶ��20 mL 18.4mol��L��1�������� |
|
C����50mL 8 mol��L��1Ũ������10g���⻯�̹�����ȡ���� |
|
D����5��l07Pa��500�������ý���������£��������������ϳɰ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�����ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ� ���ͣ�ѡ����
�ڸ��������£����мӵ�������ڻ�ѧ��Ӧ����ȫ���ĵ���
A����50 mL 12 mol/L���Ȼ���ˮ��Һ�������������̹�����ȡ����
B����100 mL 3 mol/L���������5.6 g��
C����״���£���1 g��ƬͶ��20 mL 18.4 mol/L��������
D����5��107Pa��500�������ý���������£�1 mol������3 mol������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�츣��ʡ��һ��ѧ����ĩ������ѧ�Ծ� ���ͣ�ѡ����
�ڸ��������£����л��������ڻ�ѧ��Ӧ���ܱ���ȫ���ĵ���
A����30 ml 12mol/LŨ������8.7g �������̹�����ȡ����
B������£���2.7g ��ƬͶ�뵽20 ml 18 mol/L��Ũ������
C����100 ml 3 mol/L ���������5.6g ��
D����Ba(OH)2��NaOH��0.1mol�Ļ����Һ��ͨ���״����2.8L CO2 ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com