
关于锌铜—稀硫酸原电池的叙述,正确的是( )
A. 氢离子在铜表面被氧化,产生气泡
B. 溶液中的阴离子SO42-移向负极
C. 电子经导线从负极流向正极,再经溶液从正极流向负片
D. 金属铜参与了电极反应
科目:高中化学 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:选择题
下列各组有机物中,不论二者以何种比例混合,只要总质量—定,完全燃烧时CO2的质量不变的是
①.CH4、C2H6 ②C3H6、C3H8 ③C2H4、C3H6O ④C2H4、C3H6
A. ①② B. ②③ C. ③④ D. ④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
有关晶体的结构如下图所示,下列说法中错误的是
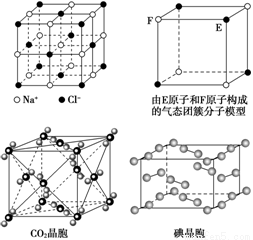
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.该气态团簇分子的分子式为EF或FE
C.在CO2 晶体中,一个CO2 分子周围有12个CO2 分子紧邻
D.在碘晶体中,碘分子的排列有两种不同的方向
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:简答题
Ⅰ.在恒温条件下,将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。
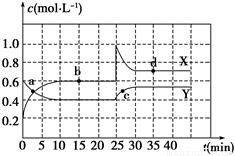
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):____________________。
(2)0~10min化学反应速度V(X)=__________________。
(3)比较Y在0~10min和10~20min时平均反应速率的大小:v(0~10)_______ v(10~20)(填“<”、“>”或“=”),原因是________________。
(4) a、b、c、d四个点中,表示化学反应处于平衡状态的点是_________,理由是__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A. 非极性键可能存在单质中,也可能存在化合物中
B. 含有离子键的化合物不可能含有非极性键
C. 盐酸中含有H+和Cl-,故HCl为离子化合物
D. 含有共价键的化合物不可能是离子化合物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:选择题
将30mL 0.5mol/L NaOH 溶液加水稀释到500mL ,稀释后溶液中NaOH的物质的量浓度为( )
A. 0.3 mol/L B. 0.03 mol/L C. 0.05 mol/L D. 0.04 mol/L
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三下学期第一次统测理综化学试卷(解析版) 题型:简答题
中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3, 工艺流程简图如下:
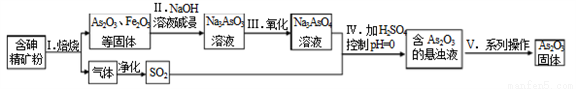
回答下列问题:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是______。
A.工业制硫酸 B.漂白纸张 C.自来水消毒
(2)过程II中发生的反应______氧化还原反应(填“是”或“不是”)。
(3)过程V中系列操作为_______ (填化学实验基本操作名称)。
(4)①过程I中焙烧As2S3的化学反应方程式为_______________。
②过程IV中生成As2O3的离子反应方程式为_______________。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中
电解含AsO33-的溶液,阳极的电极反应式为______________。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液l00mL。
b.分别移取25.00mL上述溶液,用0.02500 mol·L-1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二〜图四所示。
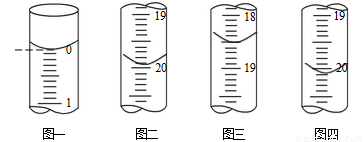
①描述滴定终点的现象_____________________。
②粗产品中As2O3的质量分数为______________ (用含有m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A. 向Al2(SO4)3溶液中加入过量氨水:Al3+ + 4NH3•H2O = AlO2- + 4NH4+ + 2H2O
B. 将氨气通入盐酸中:NH3 + H+ = NH4+
C. 将铜箔投入氯化铁溶液中:Fe3+ + Cu = Fe2+ + Cu2+
D. 向NaHSO4溶液滴加Ba(OH)2溶液至溶液恰好呈中性:H++OH-+Ba2++SO42-═BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三实验班第六次月考理综化学试卷(解析版) 题型:填空题
(12分)乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解。
(1)探究草酸的酸性
①已知:25℃ H2C2O4 K1=5.4×10?2 ,K2=5.4×10?5;H2CO3 K1=4.5×10?7 K2= 4.7×10?11
下列化学方程式正确的是
A.H2C2O4+CO32? = HCO3?+HC2O4? B.HC2O4?+CO32? = HCO3?+C2O42?
C.H2C2O4+CO32? = C2O42?+H2O+CO2? D.2C2O42?+CO2+H2O = 2HC2O4?+CO32?
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是 。
A.c(H2C2O4)>c(HC2O4?)
B.c(Na+)+c(H+)=2 c(C2O42?)+ c(HC2O4?)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4?)
D.c(H2C2O4)+c(C2O42?)+c(HC2O4?)=0.02mol/L
(2)用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度。
实验步骤:准确称取1gNa2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4 ,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
①高锰酸钾溶液应装在 滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是: 。
③下列操作可能使测量结果偏高的是
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算Na2C2O4的纯度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com