
| A. | Li能在空气中燃烧 | B. | Li2O只有共价键 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受热不分解 |
分析 在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,所以根据镁元素的相关性质判断锂的有关性质,据此解答.
解答 解:在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性.
A.镁能够在空气中燃烧生成氧化镁,所以锂也能在空气燃烧生成氧化锂,故A正确;
B.氧化镁为离子化合物,含有离子键,所以氧化锂含有离子键,故B错误;
C.碳酸镁为沉淀,所以碳酸锂难溶于水,故C错误;
D.氢氧化镁不稳定受热易分解,所以氢氧化锂性质不稳定受热易分解,故D错误;
故选:A.
点评 本题考查了元素周期表知识,明确对角线规则是解本题关键,根据Mg及其化合物的性质利用知识迁移的方法分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和④ | C. | ④和⑥ | D. | ③和⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成1mol ClO2,转移电子数为NA | B. | 该反应为复分解反应 | ||
| C. | H2SO4发生氧化反应 | D. | NaClO3是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ Na+ SO42- OH- | B. | Ca2+K+ HCO3-OH- | ||
| C. | Na+ H+ CH3COO- SO42- | D. | Ba2+ K+NO3-Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
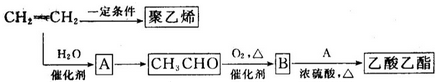
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
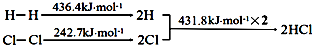
| A. | H-H键比Cl-Cl键稳定 | |
| B. | △H=-184.5 kJ•mol-1 | |
| C. | 正反应活化能比逆反应活化能高 | |
| D. | 在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
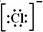 ;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.
;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com