
| A. | Ga(OH)3酸性强于Al(OH)3 | B. | Al(OH)3酸性强于Ga(OH)3 | ||
| C. | Ga(OH)3碱性强于Al(OH)3 | D. | Al(OH)3碱性强于Ga(OH)3 |
科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+═Cu+2Na+ |
| B | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-═H2O |
| C | 用惰性电极电解NaCl溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | 用惰性电极电解MgBr2溶液 2Br-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Br2 |
| D | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,一定只生成一种盐 | |
| C. | 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键 | |
| D. | CaZ、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )是否能使酸性KMnO4溶液褪色,可先将环戊烯溶于适当的溶剂,再慢慢滴入酸性KMnO4溶液并不断振荡.实验中最适合用来溶解环戊烯的试剂是( )
)是否能使酸性KMnO4溶液褪色,可先将环戊烯溶于适当的溶剂,再慢慢滴入酸性KMnO4溶液并不断振荡.实验中最适合用来溶解环戊烯的试剂是( )| A. | 四氯化碳 | B. | 酒精 | C. | 甲苯 | D. | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量NaHCO3溶液反应 | |
| B. | 澄清石灰水与过量NaHCO3溶液反应 | |
| C. | Ca(HCO3)2溶液与过量NaOH溶液反应 | |
| D. | 澄清石灰水与过量Ca(HCO3)2溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡吸热反应均需在加热条件下才能发生 | |
| B. | 离子化合物中不可能含有共价键 | |
| C. | 液氨作为清洁能源的反应原理是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | |
| D. | 实验收集NO和乙烯常用排水法不能用排空气法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
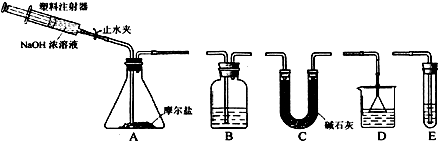
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com