工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:

(1)己知反应一经发生,铂铑合金网就会处于红热状态.写出氨催化氧化的化学方程式:
;当温度升高时,该反应的平衡常数K值
(填“增大”、“减小”或“不变”).
(2)硝酸厂尾气常用的处理方法是催化还原法:催化剂存在时用H
2将N0
2还原为N
2.已知:
2H
2(g)+0
2(g)=2H
20(g)△H=a kJ?mol
-1N
2(g)+20
2(g)=2N0
2(g)△H=b kJ?mol
-1H
20(1)=H
20(g)△H=c kJ?mol
-1 则反应2NO
2(g)+4H
2(g)=N
2(g)+4H
20(1)的△H=
.(用a、b、c表示)
(3)①合成氨反应的化学方程式为N
2+3H
2?2NH3,该反应在固定容积的密闭容器中进行.下列各项标志着该反应达到化学平衡状态的是
(填序号)
A、容器内N
2、H
2、NH
3的浓度之比为1:3:2
B、3v
正(N
2)=v
逆(H
2)
C、容器内压强保持不变
D、混合气体的相对分子质量保持不变
E.1mol N三N键断裂,同时1mol H-H键断裂
②若在恒温条件下,将N
2与H
2按一定比例混合通入一个容积为2L的密闭容器中,5min反应达平衡,n(N
2)=1mol,n(H
2)=1mol,n(NH
3)=2mol,则反应速率v(N
2)=
,H
2的平衡转化率=
;若保持容器的温度不变,在10min时将容器的容积压缩为lL,请在答题卡坐标图中,画出从反应开始至15min时c(NH
3)随时间变化曲线示意图.




 ,
, .
.


 名校课堂系列答案
名校课堂系列答案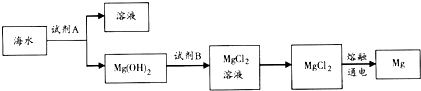
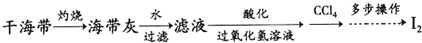

 铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下( )
铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下( )