
| 物质 | HCOOH | CH3OH | HCOOCH3 |
| 主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
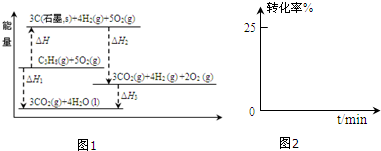
分析 (1)由图象可知,反应物总能量小于生成物总能量,则正反应为吸热反应,结合盖斯定律计算反应热;
(2)①加入甲醇,增大反应接触面积,加快反应速率,加入甲酸,甲酸能电离出H+作催化剂能加快反应速率,甲醇、甲酸都是生成物,增大生成物浓度,平衡逆向移动;
②反应开始时速率较慢,生成甲酸电离出H+作催化剂能加快反应速率,随着反应的进行,浓度逐渐减小,反应速率逐渐减慢,以此预测HCOOCH3转化率随时间的变化趋势;
③测得平衡是HCOOCH3的转化率为25%,结合酯水比为1:2以及K=$\frac{c(HCOOH)•c(C{H}_{3}OH)}{c(HCOOC{H}_{3})•c({H}_{2}O)}$计算;
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景,酸性条件下形成原电池反应时,负极发生氧化反应,HCOOH被氧化生成二氧化碳,正极发生还原反应,氧气被还原生成水.
解答 解:(1)①由图象可知,反应物总能量小于生成物总能量,则正反应为吸热反应,即△H>0,故答案为:>;
②由图象可知|△H|+|△H1|=|△H2|+|△H3|,因△H1、△H2、△H3都小于0,则△H=△H1-△H2-△H3,故答案为:△H1-△H2-△H3;
(2)①加入甲醇,增大反应接触面积,加快反应速率,加入甲酸,甲酸能电离出H+作催化剂能加快反应速率,甲醇、甲酸都是生成物,增大生成物浓度,平衡逆向移动,即甲醇:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移;甲酸:甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移,
故答案为:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移;甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移;
②反应开始时速率较慢,生成甲酸电离出H+作催化剂能加快反应速率,随着反应的进行,浓度逐渐减小,反应速率逐渐减慢,以此预测HCOOCH3转化率随时间的变化趋势为 ,故答案为:
,故答案为: ;
;
③测得平衡是HCOOCH3的转化率为25%,结合酯水比为1:2,设HCOOCH3为1mol,则水为2mol,平衡生成HCOOH、CH3OH都为0.25mol,剩余HCOOCH30.75mol,水1.75mol,
K=$\frac{c(HCOOH)•c(C{H}_{3}OH)}{c(HCOOC{H}_{3})•c({H}_{2}O)}$=$\frac{0.25×0.25}{0.75×1.75}$=0.048,
故答案为:0.048;
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景,酸性条件下形成原电池反应时,负极发生氧化反应,HCOOH被氧化生成二氧化碳,电极方程式为2HCOOH-4e-=2CO2 ↑+4H+,正极发生还原反应,氧气被还原生成水,电极方程式为O2 +4e-+4H+=2H2O,
故答案为:O2 +4e-+4H+=2H2O; 2HCOOH-4e-=2CO2 ↑+4H+.
点评 本题考查较为综合,为高考常见题型,侧重于考生对反应热、化学平衡其影响因素以及化学电源的理解和应用的考查,对化学平衡常数简单计算的掌握,注重考查学生知识迁移、读图及表达能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )
自来水管道经历了从铸铁管→镀锌管→PVC管→PPR热熔管等阶段,铸铁管、镀锌管被弃用的原因之一,可以用原电池原理来解释,示意图如图所示,下列有关说法不正确的是( )| A. | 如果是镀锌管,则a端为Zn,是负极,产生Zn2+,不但会造成管道锈蚀,Zn2+溶于自来水也对人体有害 | |
| B. | b端发生的电极反应为:ClO-+H2O-2e-═Cl-+2OH- | |
| C. | 由于该原电池原理的存在,一定程度上减弱了自来水中余氯的杀菌消毒功能 | |
| D. | 从自来水厂到用户,经过该类管道的长期接触,自来水的酸碱性发生了变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 | |
| D. | 分别向等体积的上述溶液中加入100 mL,水,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
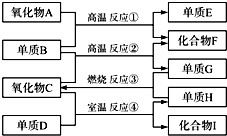 已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空:
已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应.据此,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应4FeS2+11O2=2Fe2O3+8SO2中,每生成1molSO2转移电子数为5.5NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 50g46%的乙醇水溶液中,含氢原子总数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
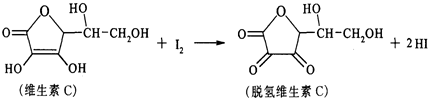
| A. | 上述反应为 取代反应 | |
| B. | 维生素C在酸性条件下水解只得到1种产物 | |
| C. | 滴定时可用淀粉溶液作指示剂 | |
| D. | 维生素C的分子式为C6H10O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
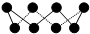
| A. | ①②③④⑤ | B. | ①③④⑤⑥ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com