
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则 N4(g) = 2N2(g)ΔH为( )
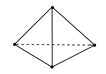
A.+882 kJ·mol-1B.-882kJ·mol-1C.+1216 kJ·mol-1D.-1216 kJ·mol-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度下气体反应达到化学平衡,平衡常数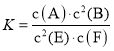 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
A.恒容时,向容器中充入稀有气体,反应速率不变
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s)A(g)+2B(g)
D.正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行电解。A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。则:

(1)电源的F端为_____________极。
(2)A中发生反应的化学方程式为________________。
(3)在B中观察到的现象是____________,______________,_________
(4)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168L,,B中析出硫酸钠晶体。若电解过程中无其他副反应发生,经测定电解后,A中溶液体积恰为1000mL,则A溶液的pH为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y具有保肝、抗炎、增强免疫等功效,可由X制得。下列有关化合物X、Y的说法正确的是

A.一定条件下X可发生氧化、取代、消去反应
B.1 mol Y最多能与4mol NaOH反应
C.X与足量H2反应后,每个产物分子中含有8个手性碳原子
D.等物质的量的X、Y分别与足量Br2反应,最多消耗Br2的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代
B.合成纤维是利用自然界的纤维材料通过化学合成方法得到的
C.研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果
D.碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物甲。试回答:
(1)X单质和Z单质在一定条件下可生成化合物乙。
①乙的电子式为________________,化学键类型为________________,晶体类型为________________;
②实验室制取乙的化学方程式为_______________________________________。
(2)由M、Y、L三种元素组成的物质焰色反应显浅紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是__________________________(用离子方程式表示);若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是_____________________,原因是____________________________________________________________________。
(3)NY2与水反应生成Y2X2和化合物甲的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。25 ℃时,向0.100 mol·L1 Na2C2O4溶液中缓缓通入HCl气体(忽略溶液体积的变化)。下列指定溶液中微粒的物质的量浓度关系正确的是
A.0.100 mol·L1 Na2C2O4溶液中:c(C2O42)>c(HC2O4)>c(OH)>c(H+)
B.pH=7的溶液中:c(Cl-)=c(HC2O4)+2c(H2C2O4)
C.c(Cl-)=0.100 mol·L1溶液中:c(OH)c(H+)=c(H2C2O4)c(C2O42)
D.c(HC2O4)=c(C2O42)的酸性溶液中:c(Cl-)+c(HC2O4)<0.100 mol·L1+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在1L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是( )
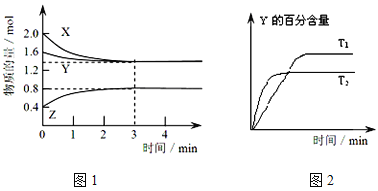
A.容器中发生的反应可表示为:X(g)+Y(g) ![]() Z(g)
Z(g)
B.保持其他条件不变,升高温度,反应的化学平衡常数K减小
C.反应进行的前3 min内,用X表示的反应速率 v(Z)=0.4mol/(L·min)
D.反应达到平衡后,增大压强,Z的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有______、______量筒、烧杯、玻璃棒。
(2)盛装0.2000 mol/L盐酸标准液应该用______式滴定管。(填“酸”或“碱”)
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_________,直到加入一滴盐酸后,溶液由_________,即到终点。
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作
正确的操作顺序为:_________。
(5)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为__________mol/L。
(6)若滴定时锥形瓶未干燥,则测定结果____________;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值_________。(填“无影响”、“偏高”或“偏低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com