
 )是一种重要的化工原料,
)是一种重要的化工原料,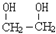 (g)△H=a kJ/mol
(g)△H=a kJ/mol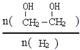 增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来.(写两条)
增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来.(写两条)分析 Ⅰ.(1)根据反应能自发的条件可知,熵增会使反应自发,放热也会使反应自发,据此判断;
(2)根据压强之比等于物质的量之比求得平衡时各物质的物质的量,进而求得浓度,根据平衡常数的定义进行计算;
(3)能使平衡体系中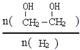 增大,即平衡向正反应方程移动,根据影响平衡移动的条件答题;
增大,即平衡向正反应方程移动,根据影响平衡移动的条件答题;
Ⅱ.(1)草酸是二元弱酸存在电离平衡,分步电离;
(2)Na2C2O4为强碱弱酸盐,草酸根水解,溶液呈碱性,一级水解程度大于二级水解程度;
(3)根据反应NH3•H2O+HC2O4-═NH4++C2O42-+H2O可知,平衡常数K=$\frac{c(NH{{\;}_{4}}^{+})c(C{\;}_{2}O{\;}_{4}{\;}^{2-})c({H{\;}_{2}O)}^{\;}}{c(NH{\;}_{3}•H{\;}_{2}O)c(H{C}_{2}O{{\;}_{4}}^{-})}$═$\frac{c(NH{{\;}_{4}}^{+})c(C{\;}_{2}O{\;}_{4}{\;}^{2-})c({H{\;}_{2}O)}^{\;}}{c(NH{\;}_{3}•H{\;}_{2}O)c(H{C}_{2}O{{\;}_{4}}^{-})}$•$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{{K}_{2}•{K}_{(N{H}_{3}•{H}_{2}O)}}{{K}_{w}}$,据此计算;
解答 解:Ⅰ.(1)根据反应能自发的条件可知,熵增会使反应自发,放热也会使反应自发,该反应为熵减的反应,所以要使反应自发,则△H<0,所以a<0,
故答案为:<;
(2)利用三段式分析,
根据反应2CO(g)+3H2(g)?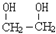 (g)
(g)
起始(mol/L) 2 3 0
转化(mol/L) 2x 3x x
平衡(mol/L)2-2x 3-3x x
有$\frac{2+3}{2-2x+3-3x+x}$=15:7,x=$\frac{2}{3}$,所以平衡时CO、H2、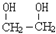 的浓度依次是$\frac{2}{3}$mol/L、1mol/L、$\frac{2}{3}$mol/L,则该温度下的化学平衡常数K=$\frac{\frac{2}{3}}{(\frac{2}{3})^{2}×{1}^{3}}$=1.5,
的浓度依次是$\frac{2}{3}$mol/L、1mol/L、$\frac{2}{3}$mol/L,则该温度下的化学平衡常数K=$\frac{\frac{2}{3}}{(\frac{2}{3})^{2}×{1}^{3}}$=1.5,
故答案为:1.5;
(3)能使平衡体系中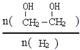 增大,即平衡向正反应方程移动,该反应为气体体积减小的放热反应,所以可采取的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来,
增大,即平衡向正反应方程移动,该反应为气体体积减小的放热反应,所以可采取的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来,
故答案为:降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来;
Ⅱ.(1)酸是二元弱酸存在电离平衡,分步电离,电离方程式为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-;
故答案为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-;
(2)Na2C2O4为强碱弱酸盐,草酸根水解,溶液呈碱性,一级水解程度大于二级水解程度,所以溶液中离子浓度大小关系 为c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+),
故答案为:碱性;c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+);
(3)根据反应NH3•H2O+HC2O4-═NH4++C2O42-+H2O可知,平衡常数K=$\frac{c(NH{{\;}_{4}}^{+})c(C{\;}_{2}O{\;}_{4}{\;}^{2-})c({H{\;}_{2}O)}^{\;}}{c(NH{\;}_{3}•H{\;}_{2}O)c(H{C}_{2}O{{\;}_{4}}^{-})}$═$\frac{c(NH{{\;}_{4}}^{+})c(C{\;}_{2}O{\;}_{4}{\;}^{2-})c({H{\;}_{2}O)}^{\;}}{c(NH{\;}_{3}•H{\;}_{2}O)c(H{C}_{2}O{{\;}_{4}}^{-})}$•$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{{K}_{2}•{K}_{(N{H}_{3}•{H}_{2}O)}}{{K}_{w}}$=$\frac{1.75×10{\;}^{-5}×5.0×10{\;}^{-5}}{.0×1{0}^{-14}}$=8.75×104,
故答案为:8.75×104.
点评 本题考查了弱电解质的电离、电离平衡溶液的计算、离子浓度大小比较、平衡移动的影响因素等,明确弱电解质电离特点及平衡常数的运用是解本题关键,难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
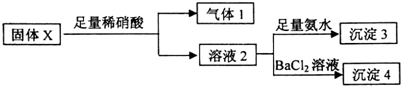
| A. | 气体1可能为NO或NO和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3或BaSO4或二者混合物 | |
| D. | 固体粉末X中一定有K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 混合物(括号内是杂质) | 所加试剂 | 操作方法 |
| A | 乙醇(水) | 生石灰 | 蒸馏 |
| B | 乙酸乙酯 (乙酸) | 饱和NaOH | 分液 |
| C | 食盐(沙子) | 水 | 过滤、蒸发 |
| D | 溴苯(Br2) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)实验室里需用480ml 0.2mol/L的硫酸铜溶液,若以胆矾(化学式为CuSO4•5H2O)为原料进行配制,请回答下列问题:
(1)实验室里需用480ml 0.2mol/L的硫酸铜溶液,若以胆矾(化学式为CuSO4•5H2O)为原料进行配制,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HX极易液化,液态HX不导电 | |
| B. | HX都是极性分子,按HF→HI分子极性递增 | |
| C. | HX都具有强烈刺激性气味的有色气体 | |
| D. | HCl水溶液的酸性:HI>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890 kJ/mol | |
| B. | 在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g)═2SO3(g)△H=-158.4kJ•mol-1 | |
| C. | NaOH(s)+$\frac{1}{2}$H2SO4(浓)═Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com