
【题目】硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+ ![]() O2(g)
O2(g) ![]() 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO3分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO3分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可).
【答案】
(1)硫酸铵(或硫酸钾)
(2)D
(3)99.75%
(4)SO3从吸收塔底部进入,吸收剂(浓硫酸)从顶部下淋,形成对流;SO2+NH3+H2O===NH4HSO3;2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑[或SO2+2NH3+H2O===(NH4)2SO3;(NH4)2SO3+H2SO4===(NH4)2SO4+H2O+SO2↑]
【解析】 根据化学平衡原理来确定的条件有D项(增大反应物浓度,使平衡正向移动)。根据化学平衡原理,降温有利于平衡正向移动,保持适宜温度是为了使催化剂效率最高。转化率为95%+(1-95%)×95%=99.75%。注意SO2用NH3吸收后再用H2SO4处理,可得相应化肥。SO2可以再次循环利用。
【考点精析】利用化学平衡移动原理以及影响因素对题目进行判断即可得到答案,需要熟知影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】今有Na2CO3、NaHCO3、NaCl组成的混合物100g,加热到质量不再减少为止。剩余残渣为84.5g,将残渣溶于水,滴入足量的AgNO3溶液得到白色沉淀,加足量的稀硝酸后大部分沉淀消失,剩余沉淀为12.26g,试计算混合物中Na2CO3、NaHCO3和NaCl的质量分数各是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C+H2O(g) ![]() CO+H2;
CO+H2;
②CO+H2O(g) ![]() CO2+H2;
CO2+H2;
(1)已知CO(g)+1/2O2(g)===CO2(g);ΔH=-283.0 kJ/mol;
H2(g)+1/2 O2(g)===H2O(g);ΔH=-285.8 kJ/mol;写出上述CO与H2O(g)反应的热化学方程式:
(2)从反应混合物中分离出H2的方法通常是以碱液洗气,根据该工业生产的实际分析,最好选用下列哪种溶液作为吸收剂? , 理由是。
A.氢氧化钠溶液
B.氨水
C.石灰水或石灰乳
(3)在实验室模拟上述反应②,830 ℃时在1 L的容器中装入CO和H2O(g)各2 mol使之反应,达到平衡时测得容器中CO2的浓度为1 mol/L,计算830 ℃时该反应的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)C(g)+D(g)已达到平衡状态( ) ①混合气体的压强
②混合气体的质量
③各气体物质的物质的量浓度
④气体的总物质的量
⑤混合气体的平均相对分子质量.
A.①②③
B.②③⑤
C.②③④⑤
D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组混合物,不能用分液漏斗分开的是 ①四氯化碳、水②乙醇、甘油③乙醇、水④苯、水⑤已烷、水⑥环已烷、苯⑦溴苯、水
A.①②③B.②③⑥C.①④⑤⑦D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用洗涤剂的主要成分是十二烷基苯磺酸钠![]() ,十二烷基苯磺酸钠是常用普通洗衣粉的主要成分,其结构可用图形来表示,端为链烃基,端为极性基。根据这一结构特点,试分析和回答下列问题:
,十二烷基苯磺酸钠是常用普通洗衣粉的主要成分,其结构可用图形来表示,端为链烃基,端为极性基。根据这一结构特点,试分析和回答下列问题:
(1)十二烷基苯磺酸钠分子在水溶液表面分布的结构示意图,应是下列各图中的图(填写序号),理由是。
(2)进入水内部的十二烷基苯磺酸钠分子,可能会以下列结构形式中的结构形式存在(填写序号),理由是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,化学反应2H2+O2═2H2O的能量变化如图所示,则反应的热化学方程式可表示为( ) 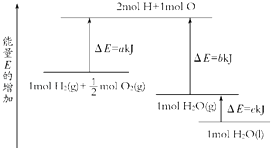
A.H2(g)+ ![]() O2(g)═H2O(g)△H=(a+b) kJmol﹣1
O2(g)═H2O(g)△H=(a+b) kJmol﹣1
B.2H2(g)+O2(g)═2H2O(g)△H=2(b﹣a) kJmol﹣1
C.H2(g)+ ![]() O2(g)═H2O(l)△H=(b+c﹣a) kJmol﹣1
O2(g)═H2O(l)△H=(b+c﹣a) kJmol﹣1
D.2H2(g)+O2(g)═2H2O(l)△H=2(a﹣b﹣c) kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO2(g)N2O4(g)△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的量浓度c随时间t的变化关系如图所示. 
(1)a、b、c、d四个点中,化学反应处于平衡状态的是点.
(2)25min时,增加了(填物质的化学式)mol.
(3)a、b、c、d四个点中所表示的反应体系中,气体颜色由深到浅的顺序是(填字母).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列问题:
(1)画出氯原子结构示意图;
(2)写出小苏打的化学式;
(3)写出实验室制氯气的离子方程式;
(4)写出红热的木炭与浓硫酸反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com