
| A. | 0.1mol•L-1CH3COOH与0.1mol•L-1氨水等体积混合(PH=7):c(NH4+)=c(CH3COO-)=c(H+)=c(OH-) | |
| B. | 0.1mol•L-1HCl溶液与0.2mol•L-1氨水等体积混合(PH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| C. | 0.1mol•L-1CH3COONa与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1 NaHCO3溶液等体积混合:c(HCO3-)>0.05mol•L-1>c(CO32-)>c(OH-) |
分析 A.混合液的pH=7,则c(H+)=c(OH-),结合电荷守恒可知:c(NH4+)=c(CH3COO-),由于氢离子和氢氧根离子浓度较小,则c(NH4+)=c(CH3COO-)>c(H+)=c(OH-);
B.反应后溶质为等浓度为一水合氨和氯化铵,混合液的pH>7,说明铵根离子的水解程度小于一水合氨的电离程度,则c(NH4+)>c(NH3•H2O),结合物料守恒可知:c(NH4+)>c(Cl-)>c(NH3•H2O);
C.根据混合液中的物料守恒判断;
D.碳酸根离子的水解程度大于碳酸氢根离子的水解程度,则碳酸氢根离子浓度增大,碳酸根离子浓度减小,即:c(HCO3-)>0.05mol•L-1>c(CO32-).
解答 解:A.0.1mol•L-1CH3COOH与0.1mol•L-1氨水等体积混合(pH=7),则c(H+)=c(OH-),结合电荷守恒可知:c(NH4+)=c(CH3COO-),由于氢离子和氢氧根离子浓度较小,则溶液中离子浓度大小为:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-),故A错误;
B.0.1mol•L-1HCl溶液与0.2mol•L-1氨水等体积混合后,溶质为等浓度为NH3•H2O和NH4Cl,混合液的pH>7,说明NH3•H2O的电离程度大于NH4+的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒c(NH4+)+c(NH3•H2O)=2c(Cl-)可知:c(NH4+)>c(Cl-)>c(NH3•H2O),由于一水合氨的电离程度较小,则溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-),故B正确;
C.0.1mol•L-1CH3COONa与0.1mol•L-1CaCl2溶液等体积混合,根据物料守恒可得:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),故C错误;
D.0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合,由于CO32-的水解程度大于HCO3-,则HCO3-浓度增大,CO32-浓度减小,溶液中离子浓度大小为:c(HCO3-)>0.05mol•L-1>c(CO32-)>c(OH-),故D正确;
故选BD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确混合液中溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | B. | 气态氢化物的稳定性:X<Z | ||
| C. | 最外层电子数:Y>W | D. | Y、z的氧化物都是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率与逆反应速率相等 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 反应停止了 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
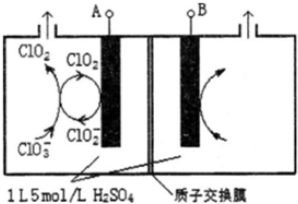 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的同分异构体中,一氯代物仅有一种的有机物一定是2,2一二甲基戊烷. | |
| B. | 若某高分子化合物对应的单体有两种,则此高聚物一定是通过缩聚反应得到的. | |
| C. | 等物质的量的乙烯和乙醇在足量氧气中完全燃烧,消耗O2和生成CO2的量相等 | |
| D. | 苯丙氨酸的结构为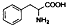 ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 | 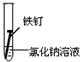 | 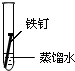 | 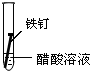 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
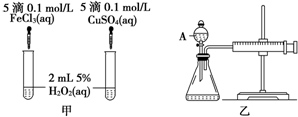 (1)下列反应属于吸热反应的是DE
(1)下列反应属于吸热反应的是DE查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:Z<M | D. | 得电子能力:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
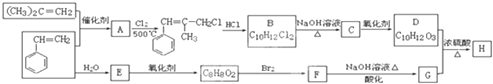
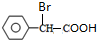 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$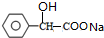 +NaBr+H2O.
+NaBr+H2O.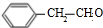 .
.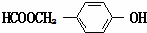 (写结构简式).
(写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com