
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
分析 (1)弱酸根质量水解程度越大,相同浓度的钠盐溶液的pH越大,则酸根离子结合质子能力越大;
①弱酸根质量水解程度越大,相同浓度的钠盐溶液的pH越大,则酸根离子结合质子能力越大;
②酸的酸性越强,酸的电离程度越大,其酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小;加水稀释促进弱酸电离,相同浓度的不同酸稀释相同的倍数,酸的酸性越弱,酸的PH变化越小;
③据强酸制取弱酸的原理分析判断;
④HClO和碳酸氢钠不反应,盐酸和碳酸氢钠反应生成二氧化碳;
(2)等体积混合后溶液中碳酸根的浓度为1×l0-4mol/L,利用溶度积计算需要钙离子浓度,再根据稀释定律计算所需CaCl2溶液的最小浓度.
解答 解:(1)弱酸根质量水解程度越大,相同浓度的钠盐溶液的pH越大,则酸根离子结合质子能力越大,根据溶液pH知,CO32-的水解程度最大,则CO32-结合质子能力最强,故答案为:CO32-;
①弱酸根质量水解程度越大,相同浓度的钠盐溶液的pH越大,则酸根离子结合质子能力越大,根据溶液pH知,CO32-的水解程度最大,则CO32-结合质子能力最强,故答案为:CO32-;
②酸的酸性越强,酸的电离程度越大,其酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小,根据表中数据知,酸性最强的酸是CH3COOH、酸性最弱的酸是C6H5OH;加水稀释促进弱酸电离,相同浓度的不同酸稀释相同的倍数,酸的酸性越弱,酸的PH变化越小,酸性最弱的酸是C6H5OH,则pH变化最小的是C6H5OH,
故答案为:D;C;
③据各种酸对应钠盐的pH可知,其酸性醋酸的酸性比碳酸强,醋酸的酸性比HCN强,碳酸的酸性比HClO强,碳酸的酸性比苯酚强,苯酚的酸性比HCO3-强,所以CO2+H2O+NaClO═NaHCO3+HClO和CO2+H2O+C6H5ONa═NaHCO3+C6H5OH,所以CD错误,故答案为:CD;
④HClO和碳酸钠不反应,盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大,离子方程式为2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO,
故答案为:2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO;
(2)等体积混合后溶液中碳酸根的浓度为2×l0-4mol/L÷2=1×l0-4mol/L,要生成CaCO3沉淀需要钙离子浓度为$\frac{2.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=2.8×l0-5mol/L,故需要CaCl2溶液的最小浓度为2.8×l0-5mol/L×2=5.6×l0-5mol/L,
故答案为:5.6×10-5.
点评 本题属于拼合型题目,涉及盐类水解的应用、平衡常数和溶度积计算,难度中等,(3)中注意等体积混合后碳酸根的浓度变化情况.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | c (A-)>c (B+)>c (H+)>c (OH-) | B. | c (B+)=c (A-)>c (H+)=c (OH-) | ||
| C. | c (OH-)-c (H+)=c(HA) | D. | c (B+)+c (H+)=c (A-)+c (OH-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.336L | B. | 0.224L | C. | 0.168L | D. | 0.504L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
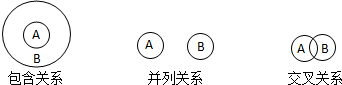
| A. | 纯净物与混合物属于包含关系 | |
| B. | 胶体与分散系属于交叉关系 | |
| C. | 置换反应与离子反应属于交叉关系 | |
| D. | 氧化还原反应与分解反应属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上粗硅的制备和提纯 | B. | 工业上从海水中提取溴或镁 | ||
| C. | 工业上采用“侯氏制碱法”制纯碱 | D. | 工业上利用合成氨实现氮的固定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mL | B. | 4mL | C. | 6mL | D. | 8mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com