
【题目】写出下列反应的热化学方程式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量:________。
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(g),放出1366.8kJ的热量______。
【答案】N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ/mol
【解析】
(1)N2(g)与H2(g)完全反应生成1molNH3(g)放热46.1kJ热量,生成2mol氨气放热92.2kJ,标注物质聚集状态和对应反应焓变写出热化学方程式;
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(g),放出1366.8kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式。
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量,生成2molNH3(g),放热92.2kJ,标注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)+3H2(g)=2NH3(g) ![]() H=-92.2kJ/mol;
H=-92.2kJ/mol;
因此,本题正确答案是:N2(g)+3H2(g)=2NH3(g) ![]() H=-92.2kJ/mol;
H=-92.2kJ/mol;
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(g),放出1366.8kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ![]() H=-1366.8kJ/mol,
H=-1366.8kJ/mol,
因此,本题正确答案是:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ![]() H=-1366.8kJ/mol。
H=-1366.8kJ/mol。


科目:高中化学 来源: 题型:
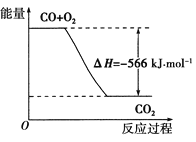
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,下列说法正确的是( )
A.CO的燃烧热为-283 kJ·mol-1
B.CO的燃烧热为566 kJ·mol-1
C.CO的燃烧热ΔH=-283 kJ·mol-1
D.如图可表示由CO生成CO2的反应过程和能量关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)反应设计的原电池如图所示。请回答下列问题:
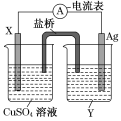
(1)电极X的材料是____,电解质溶液Y是____。
(2)外电路中的电子是从_____电极流向_____电极。
(3)银电极上发生的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。
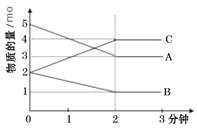
(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)能说明该反应已达到平衡状态的是_______
A.υ(A)=2υ(B) B.容器内气体密度不变
C.v逆(A)=υ正(C) D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______。
(5)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=_______,V6=_______。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为 _____基态铝原子核外电子云形状有_________(填名称)。
(2)丙烯腈(CH2=CH-CN)分子中α键和![]() 键的个数比为_____,分子中碳原子轨道的杂化类型是___
键的个数比为_____,分子中碳原子轨道的杂化类型是___
(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
(4)钛存在两种同素异构体,![]() 采纳六方最密堆积,
采纳六方最密堆积,![]() 采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由
采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由![]() 转变为
转变为![]() 晶体体积_____(填“膨胀”或“收缩”)。
晶体体积_____(填“膨胀”或“收缩”)。
(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。
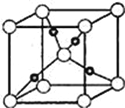
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为____,若阿伏伽德罗常数为NA,晶胞的边长为a pm,该晶体的密度为__gcm﹣3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。

回答下列问题:
(1)写出下列各物质的化学式:X____、Y_____、A_____、B_____、C____。
(2)反应①的的化学方程式为_____,反应②的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com