
【题目】短周期元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列说法不正确的是( )
A. X是钠元素B. 离子半径X+>Z2-
C. 同族元素中Z的氢化物稳定性最强D. 同周期元素中Y的非金属性最强
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.在透明的溶液中:Na+、K+、MnO ![]() 、CO
、CO ![]()
B.pH>7的溶液中:Fe2+、Cu2+、SO42﹣、Cl﹣
C.有SO42﹣存在的溶液中:K+、Mg2+、Ag+、NO ![]()
D.加入金属铝产生H2的溶液中:NH4+、Na+、SO ![]() 、CH3COO﹣
、CH3COO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是( ) 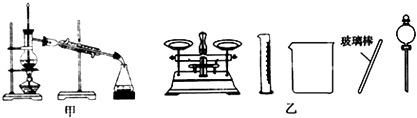
A.可用碱式滴定管量取12.85mL的KMnO4溶液
B.实验室蒸馏石油可用如图甲所示实验装置
C.取用金属钠或钾时,没用完的钠或钾要放回原瓶
D.配制500mL 0.4molL﹣1 NaCl溶液,必要的仪器如图乙所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用碱式滴定管量取0.10 mol·L-1NaOH溶液,开始时仰视读数,读数为1.00 mL,取出部分溶液后俯视读数,读数为11.00 mL。该学生实际取出的液体体积( )
A.大于10.00 mLB.小于10.00 mL
C.等于10.00 mLD.等于11.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应与能量有着密不可分的关系,回答下列问题.
(1)居民使用的管道煤气主要成分是H2、CO和少量CH4 , H2、CO和CH4的燃烧热(注:燃烧热是指在25℃,101kPa时,1mol可燃物质完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol.)数据如表:
物质 | H2 | CO | CH4 |
燃烧热(kJmol﹣1) | 285.8 | 283.0 | 890.0 |
天然气已经成为城市居民使用的主要生活能源.使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大(填“空气”或“天然气”)的进入量或减少(填“空气”或“天然气”)的进入量.1m3(标准状况)甲烷在25℃,101kPa时,充分燃烧生成二氧化碳气体和液态水时释放的热能是kJ.
(2)燃料电池是一种高效、环境友好的发电装置.氢氧燃料电池已用于航天飞机.以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为 , 这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将(填“增大”“减小”或“不变”).
(3)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.回答下列问题: 锌为极,该电极上发生反应(“氧化”或“还原”),电极反应式为 , 该原电池的总反应离子方程式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
回答下列问题:
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、 .
(2)上述反应是否都是氧化还原反应(填“是”或“否”);写出反应①的化学方程式 .
(3)反应①后过滤的沉淀为 , 简述确定此物质中金属元素及其价态的操作过程 .
(4)利用铝制得的镁铝合金用途很广泛,比如用作手机机身,某课外活动小组欲对某一品牌手机机身的铝镁合金进行研究,测定其中铝的质量分数.过量盐酸
I.他们利用盐酸、氢氧化钠溶液设计下列实验方案:
方案:铝镁合金 ![]() 溶液
溶液 ![]()
![]() 称量灼烧产物的质量.用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是 .
称量灼烧产物的质量.用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是 .
II.拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示:
当加入60~70ml氢氧化钠溶液时,请写出发生的离子方程式 . 你判断,根据图数轴中的数据能否求出合金中铝的质量分数?(选填“能”或“不能”).
下列①②两题选一题作答.(多答不给分)
①若不能求出合金中铝的质量分数,请说明理由.
②若能求出合金中铝的质量分数,则铝的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g).半水煤气经过下列步骤转化为合成氨的原料.![]()
完成下列填空:
(1)半水煤气含有少量硫化氢.将半水煤气样品通入溶液中(填写试剂名称),出现 , 可以证明有硫化氢存在.
(2)半水煤气在铜催化下实现CO变换:CO+H2O ![]() CO2+H2 , 若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)= .
CO2+H2 , 若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)= .
(3)碱液吸收法是脱除二氧化碳的方法之一.已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是;缺点是 . 如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?写出这种方法涉及的化学反应方程式.
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案.取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数.
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ、方框中.
②该实验方案中,步骤(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某糕点主要由面粉、花生油和鸡蛋清焙制而成.下列说法正确的是( )
A.该糕点不含糖类物质
B.淀粉与葡萄糖互为同分异构体
C.淀粉、油脂和蛋白质都能水解
D.淀粉、油脂和蛋白质都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下四种微粒14N、15N、N2、N4(结构为  ),已知断裂1mol N﹣N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N﹣N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
A.14N2与15N2互为同位素,N4与N2互为同素异形体
B.N4属于一种新型的化合物
C.14N与15N化学性质不相同
D.1mol N4气体完全转变为N2将放出882kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com