
分析 (1)①Al原子原子核外电子层数为3、最外层电子数为3;
②电解熔融的TiCl4可以制得金属钛,TiCl4在熔融状态下可以导电,属于离子化合物;
在1070K 用熔融的镁在氩气中还原TiCl4可得多孔的海绵钛,即发生还原反应生成Ti与氯化镁;
(2)CuFeS2中Fe元素化合价由+2升高为+3价,S元素化合价由-2价升高为+6价,总共升高17价,氧气中氧气化合价由0价降低为-2价,总降低4价,化合价升降最小公倍数为68,故CuFeS2的系数为4、O2的系数为17,再根据原子守恒配平.
解答 解:(1)①对应主族元素,周期数=电子层数、主族族序数=最外层电子数,Al原子原子核外电子层数为3、最外层电子数为3,则Al处于周期表中:第三周期ⅢA族,
故答案为:第三周期ⅢA族;
②电解熔融的TiCl4可以制得金属钛,TiCl4在熔融状态下可以导电,属于离子化合物;
在1070K 用熔融的镁在氩气中还原TiCl4可得多孔的海绵钛,即发生还原反应生成Ti与氯化镁,反应方程式为:2Mg+TiCl4$\frac{\underline{\;1070K\;}}{氩气}$Ti+2MgCl2 ,
故答案为:离子;2Mg+TiCl4$\frac{\underline{\;1070K\;}}{氩气}$Ti+2MgCl2 ;
(2)CuFeS2中Fe元素化合价由+2升高为+3价,S元素化合价由-2价升高为+6价,总共升高17价,氧气中氧气化合价由0价降低为-2价,总降低4价,化合价升降最小公倍数为68,故CuFeS2的系数为4、O2的系数为17,根据原子守恒配平后方程式为:4 CuFeS2+2 H2SO4+17 O2═4 CuSO4+2 Fe2(SO4)3+2 H2O,
故答案为:4;2;17;4;2;2.
点评 本题考查氧化还原反应配平、结构与位置关系、信息获取与迁移应用等,掌握氧化还原反应常用配平方法.


科目:高中化学 来源: 题型:选择题
| A. | 沉淀中OH-的质量为(n-m)g | |
| B. | 反应过程中转移电子的物质的量为$\frac{n-m}{17}$mol | |
| C. | 标准状况下生成NO的体积为$\frac{2.24(n-m)}{51}$L | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{bv}{1000}$)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入氯水后,溶液褪色且酸性减弱 | |
| B. | 是酸性氧化物,溶于水得稳定的亚硫酸 | |
| C. | SO2气体通入NaOH溶液一定得到Na2SO3 | |
| D. | S、SO2、SiO2三种物质均能与NaOH溶液反应,各自又能与某些酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 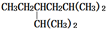 的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化 | |
| C. | 总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保证装置不漏气 | |
| B. | 镁带称量后,用砂皮擦去表面的氧化层 | |
| C. | 用针筒注入硫酸后,拔出速度要快 | |
| D. | 镁带的质量要使产生的氢气足以计量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物稳定性:PH3>H2S>HCl | B. | 沸点:H2O>HF>HCl | ||
| C. | 原子半径:S>F>O | D. | 酸性:HClO>HNO3>H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
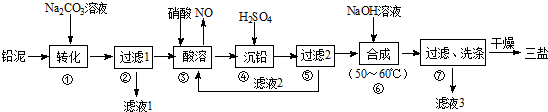
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com